Закон Бугера-Ламберта-Бера
Объектами исследования при проведении бактериологического контроля лечебно-профилактических учреждений являются:
воздушная среда;
* различные объекты внешней среды;
* хирургический инструментарий;
* шовный материал;
* руки хирургов и кожа операционного поля. Бактериологическое исследование микробной обсемененности предметов внешней среды предусматривает выявление стафилококка, синегнойной палочки, бактерий группы кишечных палочек и патогенных грибов.
Отбор проб
Взятие смывов производят стерильным ватным тампоном на палочках, вмонтированных в пробирки, или марлевыми салфетками размером 5x5 см. Для увлажнения тампонов в пробирки с тампонами наливают по 2,0 мл стерильного физиологического раствора.
Для выделения стафилококков посев делают непосредственно на чашку Петри с желточно-солевым агаром, для выделения бактерий группы кишечных палочек — посев на среду Эндо (дальнейшие исследования по соответствующим схемам).
Для обнаружения патогенных грибов производят посев на среду Сабуро, наблюдают 5 суток при 21°С. Кроме того, производят посевы в среды накопления — для стафилококков в 6,5% хлористого натрия, для бактерий группы кишечных палочек — в 10—20% желчный бульон. Через сутки инкубирования при 37°С делают пересев на среду Эндо и жел-точно-солевой агар. При обнаружении подозрительных колоний производят их микроскопию и далее исследуют по соответствующим схемам.
Для выявления синегнойной палочки специальные посевы можно не производить, так как она дает ползущий рост с характерным запахом земляничного мыла на среде Эндо.
Правила отбора проб для контроля стерильности в лечебно-профилактических учреждениях
Забор проб производят в стерильные емкости с соблюдением строжайших правил асептики.
Посев в обязательном порядке производят в три питательные среды:
* сахарный бульон Хоттингера (0,5 и 1% глюкоза);
* тиогликолевую среду;
* бульон Сабуро.
При посеве изделия или его части непосредственно в питательную среду следует соблюдать следующее условие — среды должно быть достаточно для полного погружения изделия.
Перед посевом емкость с отобранными образцами протирают стерильной марлевой салфеткой, обильно смоченной 6% раствором перекиси водорода, и оставляют на 30 минут. Затем вносят в бокс. За 1,5—2 часа до начала работы в боксе и предбокснике на 1—1,5 часа включают бактерицидные лампы.
Перед входом в бокс работники лаборатории тщательно моют руки теплой водой с мылом и щеткой, вытирают стерильным полотенцем, надевают в предбокснике на ноги бахилы, стерильные халаты, 4-слойные маски, шапочки, стерильные перчатки.
Посевы в бульон Хоттингера и тиогликолевую среду выдерживают в термостате при температуре 37°С, среду Сабуро — при температуре 20—22°С.
Посевы инкубируют в термостате в течение 14 суток.
Материал стерилен при отсутствии роста во всех посевах. Материал не стерилен при росте микрофлоры.
Бактериологический контроль эффективности обработки кожи операционного поля и рук хирургов
Смывы с кожи операционного поля и рук хирургов производят стерильными марлевыми салфетками размером 5x5 см2, смоченными в физиологическом растворе. Марлевой салфеткой тщательно протирают ладони, околоногтевые и межпальцевые пространства обеих рук. После забора проб марлевую салфетку помещают в широкогорлые пробирки или колбы с раствором нейтрализатора (воды или физиологического раствора) и стеклянными бусами, встряхивают в течение 10 минут, производят отмыв марлевой салфетки. От-мывную жидкость засевают глубинным способом по 0,5 мл на 2 чашки Петри с мясопептонным агаром, а марлевую салфетку— 0,5% сахарный бульон. Посевы инкубируют при 37°С в течение 48 часов.
Кожа и руки стерильны при отсутствии роста микроорганизмов как на твердой, так и на жидкой питательной среде.
Закон Бугера-Ламберта-Бера
Залежність інтенсивності монохроматичного світла, що пройшло через шар забарвленого розчину (І), від інтенсивності падаючого світла (Іо), концентрації забарвленої речовини (С) і товщини шару розчину (l) визначається об’єднаним законом Бугера-Ламберта-Бера, який є основним законом світлопоглинання і лежить в основі більшості фотометричних методів аналізу:
І = Іо×10–КСl (2)
де К — коефіцієнт світлопоглинання, який залежить від природи речовини, температури, природи розчинника і довжини хвилі падаючого світла.
Якщо концентрація виражена в молях на літр, а l в сантиметрах, то К називають молярним коефіцієнтом світлопоглинання і позначають ελ. Коефіцієнт ελ є сталим для даної речовини і не залежить від концентрації розчину, товщини поглинаючого шару, інтенсивності падаючого світла, але залежить від довжини хвилі падаючого світла.
Рівняння (2) в цьому випадку буде мати вигляд:
І = Іо×10 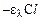 (3)
(3)
Після логарифмування виразу (3) одержимо:
lg 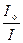 = ελ×C×l (4)
= ελ×C×l (4)
Величина lg 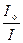 називається оптичною густиною (світлопоглинанням, абсорбцією) і позначається літерою А. Рівняння (4) в цьому випадку приймає вигляд:
називається оптичною густиною (світлопоглинанням, абсорбцією) і позначається літерою А. Рівняння (4) в цьому випадку приймає вигляд:
А = ελ×C×l (5)
і читається: оптична густина прямо пропорційна молярному коефіцієнту світлопоглинання, концентрації поглинаючої речовини і товщині шару розчину.
Відношення І/Іо називають пропусканням і позначають літерою Т (приймає значення від 0 до 1, або від 0 до 100%):
Т = 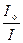 = 10
= 10 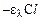 (6)
(6)
Якщо величина Т віднесена до товщини шару 1 см, то вона називається коефіцієнтом пропускання. Залежність оптичної густини від концентрації графічно зображається прямлю лінією, яка проходить через початок координат. Закон Бугера-Ламберта-бера зберігається при таких умовах, коли: пучок падаючого світла є монохроматичним і паралельним; показник заломлення середовища і температура змінюються мало; світло поглинають частинки одного виду. Якщо ці умови не зберігаються і в розчині протікає дисоціація частинок, гідроліз, полімеризація, змінюється температура, показник заломлення, то спостерігається відхилення від лінійної залежності.
Дата добавления: 2015-02-28; просмотров: 1503;
