Умови фотометричних визначень
Оскільки фотометричні методи використовуються для аналізу малих концентрацій, а переважна більшість речовин у розбавлених розчинах безбарвна або слабо забарвлена, то для проведення фотометричних вимірювань у видимій області спектра необхідно визначувані речовини перевести в інтенсивно забарвлені сполуки. З цією метою використовують неорганічні або органічні речовини (фотометричні реактиви), які в строго певних умовах утворюють з досліджуваною речовиною стійкі забарвлені сполуки. Їх і фотометрують (вимірюють світлопоглинання).
Для фотометрування розчини поміщають у скляні кювети певної товщини. Бажано, щоб оптична густина не була меншою 0.1 і більшою 0.9–1.0. Якщо ж вона виходить за вказані межі, необхідно використати кювети з більшою або меншою товщиною поглинаючого шару.
Для виділення монохроматичного світла з певною довжиною хвиль користуються приладами — спектрофотометрами, в яких монохроматорами служать диспергуючі призми або дифракційні гратки.
Прилади - фотоелектроколориметри - дають можливість виділяти з видимого спектра невелику ділянку в інтервалі довжин хвиль 20–100 нм за допомогою світлофільтрів.
На практиці вибирається той світлофільтр, при якому спостерігається максимальне світлопоглинання, тобто максимум поглинання розчину повинен відповідати максимуму пропускання (мінімуму поглинання) світлофільтра.
2. ФОТОМЕТРИЧНІ МЕТОДИ КІЛЬКІСНОГО ВИЗНАЧЕННЯ РЕЧОВИН
2.1. Метод порівняння
Ґрунтується на порівнянні оптичних густин стандартного та досліджуваного розчинів.
Аліквотну частину досліджуваного розчину переводять в забарвлений розчин і вимірюють оптичну густину Ах. Це ж роблять для одного або двох стандартних розчинів, концентрації яких С1 і С2 повинні бути близькими до концентрації досліджуваного розчину. Вимірювання проводять в тих же кюветах. Концентрацію досліджуваного розчину Сх знаходять на основі пропорційності між концентраціями і оптичними густинами:
Ах/Аст = Сх/Сст; Сх = Сст× Ах/Аст
У випадку використання двох стандартних розчинів (необхідно, щоб С1 < Cx < C2), концентрацію досліджуваного розчину розраховують за формулою:
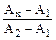 =
= 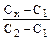 ; Сх = С1 + (С2 – С1)×(Ах – А1)/(А2 – А1)
; Сх = С1 + (С2 – С1)×(Ах – А1)/(А2 – А1)
Масу визначуваної речовини в досліджуваному розчині (mx, мг) обчислюють за формулою:
mx = Сх×Vx×Vзаг/V1
де Сх — знайдена концентрація досліджуваного розчину, мг/мл; Vзаг — загальний об’єм досліджуваного розчину, мл; V1 — об’єм досліджуваного розчину (аліквотна частина), взятого для приготування забарвленого розчину, мл; Vх — об’єм забарвленого досліджуваного розчину (місткість мірної колби), мл.
2.2. Метод калібрувального графіка
Готують серію стандартних розчинів (5–8) різних концентрацій, які переводять у забарвлену форму і фотометрують. Інтервал концентрацій вибирають такий, щоб зберігалась лінійна залежність між оптичною густиною і концентрацією (тобто не порушувався основний закон світлопоглинання). Будують графік залежності оптичної густини А від концентрації С. Для аналізу беруть такий об’єм досліджуваного розчину, щоб його оптична густина після проведення реакції з фотометричним реактивом і розбавлення в мірній колбі відповідала приблизно середині калібрувальної кривої. За виміряною величиною Ах з графіка знаходять концентрацію Сх (рис. 3).

Рис. 3. Залежність оптичної густини від концентрації розчину (калібрувальний графік)
Метод використовується переважно при проведенні серійних фотометричних аналізів розчинів, однотипних за хімічним складом.
Дата добавления: 2015-02-28; просмотров: 2027;
