Циклические (ароматические) аминокислоты
| NH2 | — | CH | — | COOH | NH2 | — | CH | — | COOH | NH2 | — | CH | — | COOH | H | — | 
| — | COOH | NH2 | — | CH | — | COOH | ||||||||
| | | | | | | | | |||||||||||||||||||||||||||||
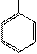
| CH2 | 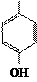
| CH2 | CH2 | CH2 | |||||||||||||||||||||||||||
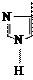
| 
| |||||||||||||||||||||||||||||||
| Фенилаланин – фен (Phe) | Тирозин – тир (Tyr) | Гистидин – гис (His) | Пролин – про (Pro) | Триптофан – три (Trp) | ||||||||||||||||||||||||||||
| Σq = 0 | Σq "-" | Σq = 0 | Σq = 0 | Σq = 0 |
Амиды
| NH2 | — | CH | — | COOH | NH2 | — | CH | — | COOH | ||
| | | | | ||||||||||
| CH2 | (CH2)2 | ||||||||||
| | | | | ||||||||||
| NH2 | — |  C C
| 
| O | NH2 | — |   C C
| O | |||
| Аспарагин – асн (Asn) | Глутамин – глн (Gln) | ||||||||||
| Σq "+" | Σq "+" |
3-й вопрос.
Cтруктурной единицей белков являются аминокислоты. Аминокислоты в белковой молекуле соединяются пептидной связью:
О
//
- С – N –
\
Н
О наличии таких связей впервые высказал предположение в 1889 г. А.Я.Данилевский. Он обратил внимание на способность белков давать своеобразную цветную реакцию:
 Белок + NaOH + CuSO4 фиолетовый цвет
Белок + NaOH + CuSO4 фиолетовый цвет
Эта связь получила название пептидная. Связь образуется таким образом:
О О
// //
 NH2 - СН – C – ОH + Н – N – СН – С – OH
NH2 - СН – C – ОH + Н – N – СН – С – OH
/ / / - Н2О
R1 Н R2
О О
// //
NH2 - СН – C –– N – СН – С – OH
/ / /
R1 Н R2
дипептид
Соединение двух аминокислот называется дипептид, трех - трипептид, черытех – тетрапептид и так далее. Пептиды именуются по названию аминокислот, входящих в их состав. При этом у всех аминокислот (кроме последней) заменяется суффикс – ин на суффикс – ил. Последняя аминоксилота в пепдиде сохраняет свое название.
О О О О
// // // //
NH2 – СН – C – N – СН – С – N – СН – C – N – СН – С – OH
/ / / / / / /
СН3 Н СН2 Н СН2 Н СН2
/ / / \
ОН SН Н3С СН3
Данное соединение представляет собой тетрапептид, так как в его состав входят остатки аминокислот: аланин, серин, цистеин, валин, – и называется: аланил-серил-цистеил-валин.
Теорию А.Я.Данилевского экспериментально подтвердил Эмиль Фишер (немецкий ученый). Он гидролизом выделил из белков 19 аминокислот, а затем осуществил синтез дипептида (гли-гли), далее – три-, тетра-, пентапептиды и т.д. (всего из 18 аминокислот). Первый белок путем синтеза получен в 1963-1965 гг. в лабораториях Катсояниса (США) и Цана (ФРГ) – это белок инсулин. В начале 20 в. синтезированы были простые пептиды.
Из разных тканей животных были выделены естественные пептиды: в 1900 г. Гулевич выделил из мышц дипептид карнозин ( 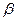 -ала и гис); в 1921 г. Гопкинс – глутатион (трипептид из глу, цис, гли).
-ала и гис); в 1921 г. Гопкинс – глутатион (трипептид из глу, цис, гли).
К активным пептидам относятся : окситоцин (9 аминокислотных остатков), вазопрессин (9 ам.к.) - гормоны, грамицидин (10 ам.к.) – антибиотик и др.
Таким образом, аминокислоты, соединяясь пептидными связями, дают пептиды и более крупные молекулы – белки.
4-й вопрос.
В организации белковых молекул рассматривают 4 структуры, или 4 уровня организации: первичная, вторичная, третичная и четвертичная структура.
Первичная структура белка – это определенная последовательность чередования аминокислотных остатков, строго специфична для каждого белка.
Впервые изучена 1-я структура в 1953 г. английским ученым Сенджером (Сангером) на инсулине. На изучение группа ученых во главе с Сенджером затратила 10 лет. В этом белке 2 цепи: А и В, где 21 и 30 аминокислот (всего 51). Эта структура поддерживается пептидными связями. В нашей стране первый белок расшифрован в 1972 г. под руководством Ю.А.Овчинникова – белок-фермент аспартатаминотрансфераза (здесь 412 аминокислотных остатков, ушло на изучение примерно 4 года). В настоящее время 1-я структура изучена у более 3 тысяч белков.
При изучении 1-й структуры белков установлены две закономерности (два принципа).
1-й - принцип структурного подобия. Суть: в разных белках в определенных участках одинаковый набор аминокислот, то есть участки: три-, тетра-, пентапептиды в молекулах разных белков одинаковой последовательности чередования аминокислот.
Например: инсулин и рибонуклеаза имеют 3 тождественных трипептида и один тождественный тетрапептид.
2-й принцип – видовая специфичность. Суть: один и тот же белок разных животных отличается по набору аминокислот в отдельных позициях полипептидной цепи.
Например: инсулин разных видов животных отличается: у свиньи 30-я аминокислота – ала; у человека 30-я аминокислота – тре. Свинья по генетическим характеристикам ближе всего к человеку. Инсулин свиньи используют при сахарном диабете, хотя возможна аллергия.
1-я структура закреплена генетически, она определяет другие структуры.
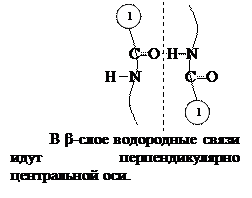
Вторичная структура – это скрученная в спираль полипептидная цепь. Различают 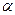 -спираль и
-спираль и 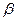 -слой. Впервые она изучена в 1956 г. на мышечных белках Полингом и Кори.
-слой. Впервые она изучена в 1956 г. на мышечных белках Полингом и Кори.
Поддерживается Н-связями, в 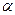 -спирали они идут вдоль, в
-спирали они идут вдоль, в 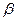 -слоях – поперек цепи.
-слоях – поперек цепи.
Параметры 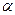 -спирали: период – 5 витков (18 аминокислот); 1 виток – 3,6 аминокислот; высота 1 витка – 0,54 нм; угол подъема витка – 26о.
-спирали: период – 5 витков (18 аминокислот); 1 виток – 3,6 аминокислот; высота 1 витка – 0,54 нм; угол подъема витка – 26о.
Процент спирализации у разных белков различен: парамиозин – 100%, миоглобин – 75%, гемоглобин – 75%, альбумин – 50%, пепсин – 28%, рибонуклеаза – 17%.
 | |||
 | |||
Третичная структура – это пространственная конфигурация, складывание цепи в пространстве, форма молекулы белка. Впервые она изучена в 1957 г. английским ученым Кендрю на миоглобине.
3-я структура очень специфична, она поддерживается S-S-связями, солеобразными, сложноэфирными. Они возникают между радикалами аминокислот.
При нарушении 3-й структуры белки теряют свою биологическую активность, свои нативные (естественные) свойства.
Сейчас установлена 3-я структура более 200 белков. Третичная структура легко подвергается денатурации – изменению под действием различных факторов (рентгеновские лучи, химические реагенты, температура, встряхивание). Денатурация изменяет нативные свойства белка. Денатурация не затрагивает 1-ю структуру. Ренатурация – восстановление 3-й структуры – иногда возможно.
Четвертичная структура – она характерна для тех белков, молекулы которых состоят из нескольких субъединиц (или протомеров). Такие молекулы называют эпимолекулы (сверхмолекулы), макромолекулы.
Фиксированное пространственное положение протомеров в таких молекулах составляет 4-ю структуру.
Впервые она изучена в 1957 г. Перутцем на гемоглобине (здесь 4 субъединицы: 2  , 2
, 2  ; М = 68.000; в
; М = 68.000; в 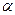 - 141 аминокислота, в
- 141 аминокислота, в 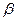 - 146).
- 146).
Сейчас выяснена 4-я структура нескольких сотен белков. Число субъединиц в эпимолекулах колеблется от 2-х до 162-х. Чаще: 2, 4, 6, 8.
Две субъединицы в молекулах инсулина, пепсина, амилазы и других белков. Белковая часть ВТМ (вируса табачной мозаики) складывается из 2130 субъединиц.
Четвертичная структура поддерживается ионными связями. В их формировании принимают участие ионы металлов, S-S-связи.
Наибольший вклад в поддержание целостности структуры вносят гидрофобные взаимодействия, водородные связи, сложноэфирные, солеобразные, дисульфидные (они возникают между радикалами аминокислот).
5-й вопрос.
1. К физической характеристике белков относят молекулярную массу (она колеблется от неск. тыс. до неск. млн.) Это высокомолекулярные вещества.
2. Белки подвижны в электрическом поле, несут определенный заряд (у большинства отрицательный – движение к аноду). Скорость передвижения зависит от массы и от величины заряда, и.э.т. рН=5, заряд меняется.
3.Белки способны адсорбировать ионы и низкомолекулярные вещества (на практике – при отравлении).
4.Белки – коллоиды, для них характерны оптические свойства: а) способны вращать плоскость поляризации света; б) рассеивать световые лучи; в) поглощать ультрафиолетовые лучи; г) способны к набуханию; д) диффузия мала.
5.Белки способны к денатурации (изменение 4-й, 3-й, 2-й структуры белков под действием кислот, щелочей, нагревание, встряхивание, действие рентгеновских лучей, ультразвуковых волн).
Химические свойства белков.
I. Гидролиз: кислотный, щелочной, ферментативный.
O O
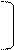
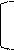 || || HCl
|| || HCl
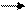
 NH2-CH-C— N-CH-C — N-CH-COOH + H2O пептиды ам.к-ты
NH2-CH-C— N-CH-C — N-CH-COOH + H2O пептиды ам.к-ты
| | | n | |
R1 H R2 H R3
II. Белки дают ряд цветных реакций, с помощью которых их можно обнаружить в биологических объектах. (Проводятся на лабораторном занятии).
Общие цветные реакции.
1. Биуретовая – на пептидные связи:
 белок + NaOH (10%) + CuSO4 (1%) фиолетовый цвет
белок + NaOH (10%) + CuSO4 (1%) фиолетовый цвет
Белки животных дают розово-фиолетовый цвет; белки растений – сине-фиолетовый. Эта реакция – на белки и пептиды, где пептидных связей более двух.
2. Нингидриновая реакция – на аминогруппу:
tо
 белок + нингидрин сине-фиолетовый цвет
белок + нингидрин сине-фиолетовый цвет
Специфические реакции на отдельные аминокислоты.
1. Ксантопротеиновая– на циклические аминокислоты:
tо
 белок + конц.HNO3 желтый цвет
белок + конц.HNO3 желтый цвет
Ksantos – желтый. Идет нитрование по бензольному кольцу радикала.
2. Реакция Фоля – на серусодержащие аминокислоты:
tо
 белок + р-в Фоля (соль Pb) черный цвет (темно-коричневый)
белок + р-в Фоля (соль Pb) черный цвет (темно-коричневый)
Существуют и другие цветные реакции на белки и свободные аминокислоты.
6-й вопрос.
Различают полноценные и неполноценные белки. Полноценные содержат все незаменимые аминокислоты, это такие аминокислоты, которые в организме человека и животного не образуются, а поступают из окружающей среды с пищей. Для человека их 8: вал, лей, иле, тре, мет, лиз, фен, трип. Неполноценные белки, то есть те, в которых отсутствует хотя бы одна незаменимая аминокислота или присутствует в недостаточном количестве.
К полноценным относят: белки молока, мяса, яиц, рыбы. К неполноценным относят растительные белки (семена бобовых, злаковых, зеленые части растений).
Оптимальное содержание незаменимых аминокислот в 1 г полноценного белка для взрослого человека (мужчины): 1) лей – 70мг; 2) фен – 60мг; 3) лиз – 55мг; 4) вал – 50мг; 5) изолей – 40мг; 6) тре – 40мг; 7) мет – 35мг; 8) трип – 10мг.
К идеалу ближе животные белки, особенно в белке, который не подвергался тепловой обработке. В большинстве растительных белков заметно не хватает одной или нескольких незаменимых аминокислот. Так, белок пшеницы содержит лишь ½ требуемого лизина, а в белке картофеля или гороха не достает 1/3 метионина.
Растительные белки хуже усваиваются: не на 95-96% (как белок молока, мяса, рыбы, яиц), а лишь на 70-80% (бобовые, картофель, овощи). Лучше усваивается молочный белок, чем мясной. Соевый белок близок по набору незаменимых аминокислот к животному (нет триптофана).
Однако один животный белок не лучший вариант. Более ценна смесь растительного белка с животным в соотношении 30 : 70 (или 50 : 50). Вегетарианство приводит к дисбалансу аминокислот (это плохо сказывается на умственной деятельности и др.). Особенно чувствительны к недостатку животного белка дети.
В сыре белка 25%, в мясе – 16-20%, в рыбе – 16-18%, в твороге – 14%, в яйцах – 13%, в горохе – 19%, в фасоли – 22%, в сое – 35%.
7-й вопрос.
1. Структурная функция (строительная). Белки – основной строительный материал. К структурным белкам относят: каллоген соединительной ткани; кератин волос, рогов, кожи, шерсти; эластин стенок сосудов, кожи. Белки образуют мышечные волокна, входят в состав нервной ткани. В комплексе с липидами белки участвуют в образовании биомембран клеток.
2. Каталитическая. Все биохимические реакции в живом организме протекают при участии ферментов. Это белки (!). В одной живой клетке насчитывают до 1 000 ферментов. Сейчас известно более 2 500 ферментов.
3. Сократительная (двигательная). Мышцы сокращаются благодаря наличию в них белков актина и миозина. Миозин проявляет АТФ-азную активность. АТФ при этом распадается, энергия идет на сокращение мышц.
4. Транспортная. Сывороточные альбумины транспортируют липиды. Другие белки крови транспортируют питательные вещества, витамины, гормоны, лекарственные препараты. Гемоглобин переносит кислород и углекислый газ – дыхательная функция.
5. Защитная. Белки-антитела защищают организм от инфекции. Они вырабатываются в ответ на поступление в организм бактерий, вирусов, токсинов.  -глобулин способствует выработке антител. Фибриноген крови переходит в фибрин и защищает организм от кровопотери. Интерферон – от вирусов.
-глобулин способствует выработке антител. Фибриноген крови переходит в фибрин и защищает организм от кровопотери. Интерферон – от вирусов.
6. Гормональная. Белки-гормоны регулируют обмен веществ. Это гормоны гипофиза (окситоцин, вазопрессин), поджелудочной железы (инсулин, глюкагон).
7. Энергетическая. При окислении белков выделяется энергия: 1 г жира – 38,9 кДж, 1 г углеводов – 17 кДж, 1 г белка – 16,1 кДж.
8. Резерв питательных веществ (резервная функция). К резервным белкам относят белки яиц, семян, икры. Они используются для питания зародыша. Кодеин (белок молока) также выполняет питательную функцию. Животные белки – поставщики незаменимых аминокислот.
8-й вопрос
По степени сложности белки делят на две большие группы: простые и сложные. Простые белки состоят только из аминокислот. Сложные белки состоят из белковой части и небелковой (простетическая группа).
Характеристика простых белков.
Среди простых белков выделяют ряд классов.
1. Альбумины. Отрицательно заряженные белки, М = 35 000 – 70 000 Да, изоэлектрическая точка рН 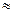 5. Растворимы в воде, выпадают в осадок в насыщенном растворе сульфата аммония. В электрическом поле наиболее подвижны, так как имеют большой заряд и сравнительно небольшую массу, легко денатурируют (даже при встряхивании).
5. Растворимы в воде, выпадают в осадок в насыщенном растворе сульфата аммония. В электрическом поле наиболее подвижны, так как имеют большой заряд и сравнительно небольшую массу, легко денатурируют (даже при встряхивании).
Это полноценные белки. Широко распространены в природе, встречаются в тканях животных и растений. К ним относятся многие ферменты. Содержатся в яичном белке, в сыворотке крови, в молоке, в мозговой ткани, в зеленых частях растений, в семенах бобовых, злаковых культур (лейкозин).
Функции: а) резерв питательных веществ для развития зародыша, так как хорошо растворимы, хорошо усваиваются, полноценны; б) каталитическая; в) транспортная (переносят сульфамидные препараты, жирные кислоты, витамины).
2. Глобулины. Отрицательно заряженные белки. М = 90 000 –150 000 Да. Изоэлектрическая точка рН 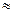 5. Не растворимы в воде, но растворимы в слабых растворах солей, кислот, щелочей. Выпадают в осадок в полунасыщенном растворе сульфата аммония.
5. Не растворимы в воде, но растворимы в слабых растворах солей, кислот, щелочей. Выпадают в осадок в полунасыщенном растворе сульфата аммония.
Это полноценные белки, широко распространенные в природе. Входят в состав семян бобовых и масличных культур, в ткани животных, в ткани животных: фибриноген, миозин, глобулины сыворотки крови, молока, яиц. Фермент АТФ-аза – глобулин.
Глобулины при электрофорезе движутся с разной скоростью и делятся на фракции ( 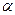 ,
, 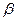 ,
, 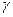 ), они отличаются по массе.
), они отличаются по массе. 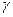 -глобулины способствуют выработке антител.
-глобулины способствуют выработке антител.
3. Проламины. Отрицательно заряженные белки. Изоэлектрическая точка рН 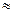 1,5-2. В воде не растворины, а растворимы в 70% этиловом спирте. Проявляют кислотный характер. Содержат: пролин - до 15%, глутамин – до 25-50%.
1,5-2. В воде не растворины, а растворимы в 70% этиловом спирте. Проявляют кислотный характер. Содержат: пролин - до 15%, глутамин – до 25-50%.
Они содержатся во всех злаках: глиадин – в семенах пшеницы, гордеин – в семенах ячменя, зеин – в семенах кукурузы, авенин – в семенах овса. Проламины выделены только из растительных объектов.
4. Протамины. Положительно заряженные белки, М = 10 000 – 30 000 Да. Это белки основного характера, изоэлектрическая точка рН = 8. Содержат 80 – 90% диаминомонокарбоновых кислот (арг, лиз) и не содержат S (цис, мет).
Содержатся в половых клетках растений: сальмин – в молоках сёмги, клупеин – в спермиях сельди.
5. Гистоны. Положительно заряженные белки, М 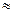 10 000 Да. Это также белки основного характера, изоэлектрическая точка рН = 8. (Так как несут положительный заряд). Содержат до 30% аргинина, лизина. Содержатся в ядрах клеток, в эритроцитах, в зобной железе.
10 000 Да. Это также белки основного характера, изоэлектрическая точка рН = 8. (Так как несут положительный заряд). Содержат до 30% аргинина, лизина. Содержатся в ядрах клеток, в эритроцитах, в зобной железе.
6. Протеиноиды. Не растворимы ни в чем, фибриллярные белки. Это белки соединительной ткани: коллаген, кератин, эластин.
Коллаген (не переваривается, не усваивается) при нагревании превращается в желатину (переваривается, усваивается). Кератин содержит до 12% цистеина, восстанавливается тиогликолем (при завивке волос), применяется в гигрометрах, растворяется под действием фермента моли кератиназы (портит шерсть).
Характеристика сложных белков.
Эти белки имеют простетическую группу небелковой природы. Их классификация основана на характере небелковой части, по которой дают название классам сложных белков.
1. Фосфопротеины. В качестве небелковой части содержат фосфорную кислоту. Остатки Н3РО4 присоединяются к молекуле белка по месту групп –ОН в радикалах серина и треонина сложноэфирными связями:
Представители: а) казеин молока. В молоке в растворенном виде содержится казеиноген. При окислении казеиноген переходит в казеин (он гетерогенен, различают 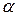 ,
, 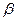 ,
, 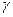 –казеины, отличны содержанием фосфора). б) вителлин яичного желтка. в) ихтулин икры рыб.
–казеины, отличны содержанием фосфора). б) вителлин яичного желтка. в) ихтулин икры рыб.
Фосфопротеины выполняют питательную функцию, входят в белки, необходимые для питания зародыша.
2. Липопротеины.
В качестве небелковой части содержат липиды (жиры и жироподобные вещества). Липопротеины участвуют в формировании клеточных мембран, митохондрий, пластидов. Выполняют структурную функцию. Содержатся в плазме крови, в молоке, в нервной ткани. Так, в сыворотке крови содержится 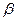 -липопротеин (где 23% белка и 77% липидов). Он выполняет транспортную функцию. Липопротеины растворимы в воде и нерастворимы в органических растворителях.
-липопротеин (где 23% белка и 77% липидов). Он выполняет транспортную функцию. Липопротеины растворимы в воде и нерастворимы в органических растворителях.
3. Гликопротеины. В качестве небелковой части содержат углеводы: глюкозу, галактозу, маннозу, гексозамин и др. Представители: муцин (в слюне), мукоид (в хрящах), кутикулярный гликопротеин, гепарин (предохраняет кровь от свертывания).
Муцин содержится в слюне и в секрете других пищеварительных желез. Защищает слизистую оболочку ротовой полости от механических повреждений. Обуславливает вязкость слюны, способствует проталкиванию пищевого комка в пищевод. Мукоид содержится в хрящах, костях, сухожилиях. Кутикулярный гликопротеин – стройматериал покровных тканей насекомых, ракообразных (50% белка и 50% хитина – производное глюкозамина из глюкозы с NH2).
4. Хромопротеины– их небелковая часть окрашена. В состав небелковой части входят пиррольные кольца, как правило, 4 кольца, соединенные с металлами: Fe, Mg, Cu. Они обусловливают красный, зеленый, синий цвет соответственно.
Представители: гемоглобин, миоглобин, хлорофиллпротеин, некоторые ферменты (цитохромы, каталаза, пероксидаза), а также гемоцианины, меланопротеины.
Гемоглобин – гем (небелковая часть: сложная структура с пиррольными кольцами) + глобин, М = 68 000. Глобин – белковая часть молекулы, образована 4-мя полипептидными цепочками. Эти цепочки попарно одинаковы – две 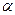 - и две
- и две  - цепочки (141 ам.к. и 146 ам.к.). Структура гема расшифрована М.В.Ненцким и Г.Фишером. Гем и глобин соединяются через остатки гистидина.
- цепочки (141 ам.к. и 146 ам.к.). Структура гема расшифрована М.В.Ненцким и Г.Фишером. Гем и глобин соединяются через остатки гистидина.
Гемоглобин, связывая О2, переходит в оксигемоглобин HbO2 –оксигенированный. При взаимодействии с СО переходит в карбоксигемоглобин (HbCO). Под действием сильных окислителей (нитраты, оксиды азота, пары нитробензола и др.) Fe(II) переходит в Fe(III) и образуется метгемоглобин, при этом присоединяется ОН-группа к гему, теряется способность переносить кислород, что ведет к удушью и смерти.
Гемоглобин содержится в эритроцитах человека и животных, выполняет дыхательную функцию.
Миоглобин – белок мышц, имеет 1 полипептидную цепь, близкую по строению к  -цепи гемоглобина, М = 17 000, 153 аминокислотных остатка в цепи. В молекуле – 1 гем. Миоглобин образует такие же производные, как и гемоглобин крови (оксимиоглобин, карбоксимиоглобин, метмиоглобин). Миоглобин обнаруживает большее сродство к О2, его рассматривают как дыхательный пигмент мышечных клеток, обеспечивающий резерв О2 в мышечной ткани.
-цепи гемоглобина, М = 17 000, 153 аминокислотных остатка в цепи. В молекуле – 1 гем. Миоглобин образует такие же производные, как и гемоглобин крови (оксимиоглобин, карбоксимиоглобин, метмиоглобин). Миоглобин обнаруживает большее сродство к О2, его рассматривают как дыхательный пигмент мышечных клеток, обеспечивающий резерв О2 в мышечной ткани.
Хромопротеины – ферменты. В качестве небелковой части – гем, подобен гему гемоглобина, содержит Fe2+. Представители: цитохромы, каталаза, пероксидаза.
5. Металлопротеины. Небелковая часть этих сложных белков представлена тем или иным металлом: Fe, Cu, Zn, Ca (без пиррольных колец). Сами металлы являются простетической группой.
Представитель: ферритин (здесь железо) – содержится в печени, селезенке. У новорожденных идет на синтез гемоглобина. Кристаллический ферритин имеет в своем составе 20% железа в окисной форме. Амилазы – металлопротеины (здесь Zn2+, Ca2+). Трансферрины – в сыворотке крови (в молекуле 2 атома Fe). Это физиологические переносчики Fe.
6. Нуклеопротеины (н.п.).
В качестве небелковой части – ДНК или РНК. Н.п. входят в состав любой клетки. Они являются компонентами ядер и цитоплазмы. Некоторые н.п. существуют в природе в виде особых частиц, обладающих патогенной активностью (вирусы).
Представители ДНП: хромосомы ядер всех клеток (ДНК + белок); вирусы (ДНК + белок).
Представители РНП: р-РНП – рибосома (р-РНК + белок); и-РНП - информасома (м-РНК + белок); т-РНП – транспортный рибонуклеопротеин (т-РНК + белок); ВТМ – вирус табачной мозаики (в-РНК + 2130 молекул белка).
Дата добавления: 2015-02-28; просмотров: 1271;
