Тема 2 Белки
План
1. Общая характеристика белков. Химический состав белков.
2. Классификация белковых аминокислот.
3. Соединение аминокислот в полипептидную цепь.
4. Структура белковых молекул.
5 Физическо-химические свойства белков.
6. Биологическая ценность белков по аминокислотному составу.
7. Функции белков в организме.
8. Классификация белков.
1-й вопрос.
Впервые белок (клейковина) был выделен итальянским ученым Беккари из муки в 1728 году. Название «белок» было дано веществу птичьих яиц, которое при нагревании свертывалось в белую нерастворимую массу.
Первые научные данные о белках получены датским ученым Мульдером. Он установил наличие в них азота и в 1839 г. предложил белки называть «протеинами» (от греческого protos – первый), подчеркнул важность этих веществ для жизни.
Белки – это азотсодержащие, высокомолекулярные, органические, полифункциональные вещества, обладающие свойствами амфотерных электролитов, полимеры, состоящие из остатков аминокислот.
Всего в природе 1012 белков, и они обеспечивают жизнь 2 млн. видов живых организмов. В организме человека начситывается около 5 млн. белков, в одноклеточном организме E.coli – 3 тыс. белков, в 1 клетке многоклеточного организма до 1000 белков.
Белки теряют свои нативные (первоначальные, естественные) физико-химические и биологические свойства под влиянием незначительных воздействий (кислот, щелочей, температуры, рентгеновских лучей, радиации, встряхивания). В цитоплазме клетки содержится примерно: воды – 80-85%, белков – 10-20%, липидов – 2%, углеводов – 1%, солей – менее 1%.
Химический состав белков. Элементарный состав белков: C – 50-55%, O – 21-25%, N – 16%, H – 7-8%, S – 1-2%, P – менее 1%. В белках постоянно содержание азота. По содержанию азота можно рассчитать количественное содержание белка (метод Кьендаля). Некоторые белки содержат в небольшом количестве Fe, I, Cu, Zn,Ca и т.д.
Например, гемоглобин (Fe); тироксин (гормон-белок щитовидной железы - I); фермент оксидаза – Cu, инсулин – Zn; РНК-полимераза – Mg; ДНКаза – Ca; хлорофиллпротеин – Mg; амилаза – Zn, Ca. Белки – высокомолекулярные соединения. Масса белков колеблется от неск. тыс до неск. млн. Да (дальтон).
Масса измеряется в а.е.м. (атомных единицах массы): 1 а.е.м. 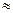 1,66.10-27кг. В биохимии массу молекул принято выражать в дальтонах: 1 Да = 1 а.е.м.
1,66.10-27кг. В биохимии массу молекул принято выражать в дальтонах: 1 Да = 1 а.е.м.
Молекула белка состоит из одной или нескольких полипептидных цепей, которые состоят из большого количества остатков специфических (белковых, протеиногенных аминокислот).
В природе примерно 200 аминокислот, и из них только 20 идут на образование белка – протеиногенные аминокислоты. Постоянно встречаются в белках 18 аминокислот и 2 амида: аспарагин (асн), глутамин (глн). Иногда встречаются: оксипролин, оксилизин, орнитин, 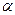 -аминоизомасляная кислота.
-аминоизомасляная кислота.
Аминокислоты – органические кислоты, где одновременно содержатся – СООН и NH2 – группы, то есть амфотерные соединения.
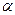
NH2 - CH – COOH

R
R – радикалы, они различны.
В состав белков входят 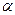 -аминокислоты, они имеют аминогруппу в
-аминокислоты, они имеют аминогруппу в 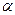 -положении.
-положении.
Аминокислоты – бесцветные кристаллические вещества, их водные растворы имеют нейтральную, кислую или щелочную реакцию.
Все белковые аминокислоты (кроме гли) содержат ассиметрический атом углерода и являются оптически активными веществами (один изомер может вращать плоскость поляризации проходящего через них луча света вправо (+), другой – влево (-). Большинство белковых аминокислот имеют L-конфигурацию – левовращающие (против часовой стрелки).
 СООН
СООН
 NH2 H
NH2 H
R
Лишь в составе гликопротеинов клеточных стенок бактерий и в антибиотиках обнаружены D- 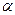 -аминокислоты: фен, глу, ала, лей, вал, про.
-аминокислоты: фен, глу, ала, лей, вал, про.
Аминокислоты – амфотерные соединения. В растворе находятся в ионизированной форме.

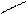
 СООН Н2О СОО- Н+ СООН
СООН Н2О СОО- Н+ СООН
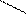
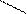
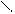 R – НС (нейтр.ср.) R – НС (кисл.ср.) R– НС
R – НС (нейтр.ср.) R – НС (кисл.ср.) R– НС
 NH2 NH3+ NH3+
NH2 NH3+ NH3+
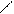 OH- СОО-
OH- СОО-
 (щел.ср.) R– НС
(щел.ср.) R– НС
NH2 + H2O
В воде заряд может быть нейтральный, отрицательный, положительный, в зависимости от количества функциональных групп. В кислой среде подавляется диссоциация карбоксильной группы и аминокислота, приобретая положительный заряд, ведет себя как катион (в электрическом поле движется к катоду). В щелочной среде подавляется диссоциация аминогруппы и аминокислота, приобретая отрицательный заряд, ведет себя как анион (в электрическом поле движется к аноду).
Значение рН, при котором суммарный электрический заряд аминокислоты равен нулю, называется изоэлектрической точкой (и.э.т.).
Аналогично ведут себя белки. Амфотерные свойства аминокислот обуславливают амфотерные свойства белков.
Большинство белков имеют: в нейтральной среде (в воде) – отрицательный заряд; в кислой среде – положительный заряд; в щелочной среде – отрицательный заряд. Изоэлектрическая точка большинства белков при рН 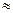 5, то есть в слабокислой среде.
5, то есть в слабокислой среде.
2-й вопрос.
Аминокислоты делят на циклические и ациклические, полярные и неполярные. В зависимости от числа амино- и карбоксильных групп и от характера радикала их делят следующим образом.
1. Моноаминомонокарбоновые (гли, ала, вал, лей, изо).
2. Диаминомонокарбоновые (арг, лиз).
3. Моноаминодикарбоновые (асп, глу).
4. Серусодержащие (цис, мет).
5. Оксиаминокислоты (сер, тре).
6. Циклические (про, гис, фен, тир, три).
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
Дата добавления: 2015-02-28; просмотров: 730;
