Аминокислоты. Аминокислоты – это органические кислоты, у которых атом водорода у α-углеродного атома замещен на аминогруппу:
Аминокислоты – это органические кислоты, у которых атом водорода у α-углеродного атома замещен на аминогруппу:
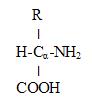
Все аминокислоты, кроме глицина, имеют хиральный атом Cα и существуют в виде двух энантиомеров (2-х оптических изомеров).
В настоящее время в состав всех изученных белков входят только L-аминокислоты. Биологический смысл этого заключён в том, что если это была бы смесь изомеров, то было бы бесконечно много диастереоизомеров.
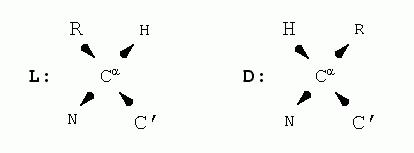
Структура аминокислот в L и D формах.
D-аминокислоты широко распространены в живой природе. Они входят в состав олигопептидов.
Из 20 основных α-аминокислот строятся белки. Некоторые аминокислоты образуются из этих 20-ти аминокислотных остатков, но в составе белковой молекулы. Например, при окислении двух сблизившихся остатков цистеина за счёт возникновения связи −S−S− образуется диаминодикарбоновая кислота – цистин (R=SH). Сшивка S–S может возникать как между различными полипептидными цепями, так и внутри одной цепи.
Фосфорилирование остатков серина:
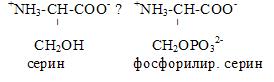
Такие ферменты как трипсин, химотрипсин, холинэстераза активны благодаря ОН группе, которая становится неактивной после фосфорилирования. ОН группа находится в активном центре фермента.
Аминокислоты в водном растворе существуют в ионизированном состоянии за счет диссоциации амино- и карбоксильных групп. Они могут существовать как кислоты (доноры) или как основания (акцепторы протонов). Природные аминокислоты делят на 3 группы:
1) алифатические (ациклические соединения жирного ряда);
2) циклические;
3) иминокислотный остаток−пролин.
Ациклические:
1) аминокислотные остатки с углеводородными хвостами (аланин, валин, глицин, лейцин, изолейцин);
2) аминокислотные остатки с гидроксильной группой (серин, треонин);
3) аминокислотные остатки с кислотным остатком (аспарагиновая и глутаминовая кислоты);
4) аминокислотные остатки с группой СОNH2 (аспарагин и глутамин);
5) аминокислотные остатки с аминогруппой (аргинин и лизин) (т.е. R содержит дополнительную аминогруппу);
6) аминокислотные остатки, содержащие серу (метионин, цистеин).
Глицин участвует в образовании нуклеиновых и желчных кислот, в образовании гема, необходим для обезвреживания в печени токсичных продуктов.
Аланин используется организмом в различных процессах обмена углеводов.
Серин входит в состав различных ферментов, липопротеинов. Заменимая аминокислота.
Треонин – незаменимая аминокислота, участвует в биосинтезе белка.
Цистеин – заменимая аминокислота, которая легко окисляется, защищая организм от веществ с высокой окислительной способностью.
Метионин – незаменимая аминокислота. Характеризуется высокой подвижностью. Она содержит СН3 группу и участвует в синтезе холина, кератина, адреналина.
Валин, лейцин и изолейцин активно участвуют в обмен веществ, в организме не синтезируются.
Аспарагин и глутамин входят в состав тормозных медиаторов нервной систем.
Циклические:
Аминокислотные остатки, содержащие π-электронные циклы,− гистидин, тирозин, триптофан, фенилаланин.
Гистидин:
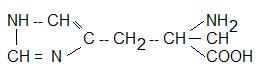
Незаменимая аминокислота, входит в состав большинства белков.
Тирозин:
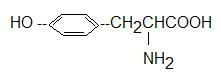
Заменимая аминокислота (в организме человека образуется при окислении фенилаланина). Это активная часть гормона щитовидной железы.
Триптофан:
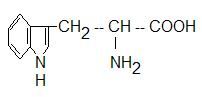
Незаменимая аминокислота (суточная потребность для человека − 0,25г). Много триптофана в γ-глобулине, в белке фибриногене (основном компоненте системы свёртывания крови).
Фенилаланин:
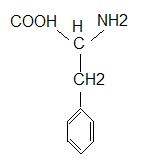
Незаменимая аминокислота (суточная потребность для человека − 1,1г). Входит в состав почти всех белков (яичный белок, гемоглобин и т.д.).
Иминокислота − пролин:
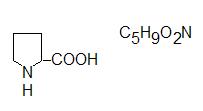
Заменимая кислота (в организме человека синтезируется из глутаминовой кислоты). Входит в состав почти всех белков. При её биохимическом окислении образуется оксипролин.
Помимо основных аминокислотных остатков встречаются несколько производных уже названных аминокислот: оксилизин, оксипролин, и др. Найдены пиролизин, фосфосерин, тироксин и др. редкие аминокислоты.
Дата добавления: 2015-02-07; просмотров: 1815;
