Первичная структура
Цепочка аминокислотных остатков в белковой молекуле возникает при образовании пептидной связи :
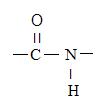
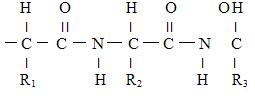
Белки имеют молекулярную массу от 6000 до нескольких миллионов. Для того чтобы установить первичную структуру (последовательность аминокислотных остатков), надо определить количество цепей, разделить их и определить аминокислоты в цепях. Число цепей можно узнать по количеству N и C концов.
Для определения N-концевой аминокислоты предложен ряд методов, в частности метод Сенгера:
1) реакции амино- и оксигрупп с 2,4-динитрофторбензолом;
2) полный гидролиз;
3) хроматография для определения аминокислоты.
Для определения природы С-концевой аминокислоты чаще всего пользуются ферментативным путем.
Все четыре атома пептидной группировки лежат в одной плоскости. Это следует из рентгеноструктурного анализа. Было показано, что пептидная связь вследствие сопряжения С=О и N-атома, на р-орбитали которого находится неподеленная пара электронов, не может рассматриваться как ординарная и вращение практически отсутствует. По этой же причине хиральный атом Сα и карбонильный атом группировки С=О и N-Cα находятся в одной плоскости, но в этой же плоскости и О, и Н. Следовательно, все атомы находятся в одной плоскости. Геометрически полипептидную цепочку можно рассматривать как образованную плоскими фрагментами структуру (по шесть атомов в одной плоскости). Возникают торсионные углы : угол ψ между Сα и С и угол φ между N и Сα.. Выражение для потенциальной энергии внутреннего вращения выглядит следующим образом:
U(ψ,φ)=U0/2*(1-cos3φ)+U0/2*(1-cos3ψ)+ 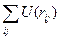 +Uкул
+Uкул
Первичная структура определена генетически; она определена составом и порядком следования аминокислот.
Реакция поликонденсации сопровождается выделением воды.
Дата добавления: 2015-02-07; просмотров: 913;
