Вопрос 36: Квантовая модель атома водорода.
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Ze (для атома водорода Z = 1), 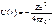 , (142)
, (142)
где r – расстояние между электроном и ядром. Состояние электрона в атоме водорода описывается волновой функцией ψ, удовлетворяющей стационарному уравнению Шредингера [см. (84)], учитывающему значение (142):
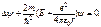 (143)
(143)
где т – масса электрона, Е – полная энергия электрона в атоме. Кулоновское поле ядра, в котором движется электрон, является центрально-симметричным, поэтому уравнение (142) целесообразно решать в сферических координатах 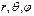 , считая, что
, считая, что 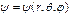 .
.
Оператор Лапласа в сферических координатах задается известной формулой  ,
,
где 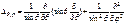
– угловая часть лапласиана. Тогда уравнение Шредингера для стационарных состояний (144)
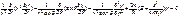
Анализ угловой части уравнения приводит к выводу, что его однозначные, конечные и непрерывные решения во всей области изменения переменных θ и φ имеют место при значениях параметра 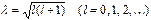 , а также при условии
, а также при условии 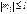 .
.
2. Энергия– получаемым из уравнения Шредингера собственным значениям энергии  (146)
(146)
в точности совпадающим с уровнями энергии в модели атома Бора!
Энергия ионизации атома водорода равна
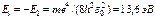 .
.
3. Квантовые числа. Общее решение уравнения Шредингера (144) записывается в виде 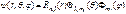 ,
,
где 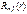 – радиальная волновая функция, зависящая только от r (n и l – целые числа), функция
– радиальная волновая функция, зависящая только от r (n и l – целые числа), функция 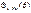 имеет два целочисленных индекса: l и ml, функция
имеет два целочисленных индекса: l и ml, функция 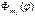 – один целочисленный индекс ml.
– один целочисленный индекс ml.
Целое число п, называемое главным квантовым числом, совпадает с номером уровня энергии [см. (146)], определяя энергию электрона в атоме;оно может принимать только целые положительные значения: n = 1, 2, 3, ... .
Целые числа l и ml, представляют собой орбитальное и магнитное квантовые числа.
Согласно формулам (95) и (98) 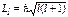
(определяет модуль момента импульса электрона) и 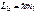
(определяет проекцию момента импульса электрона на направление z внешнего магнитного поля).
Так как при данном п орбитальное квантовое число l может принимать значения от 0 до n - 1, а каждому значению l соответствуют 2l+1 различных значений ml то кратность вырождения уровней водорода 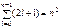 . (147)
. (147)
4. Энергетический спектр. Квантовые числа п, l, и тl позволяют более полно описать спектр испускания (поглощения) атома водорода, чем это делает теория Бора.
1) изменение орбитального квантового числа Δl удовлетворяет условию 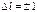 , (148)
, (148)
2) изменение магнитного квантового числа Δml, удовлетворяет условию  .
.
Дата добавления: 2015-02-25; просмотров: 1647;
