Вопрос 38: Формирование молекул.
Молекула– это наименьшая частица вещества, состоящая из одинаковых или различных атомов, соединенных химическими связями, и являющаяся носителем его основных химических и физических свойств. Преимущественно можно говорить о двух типах химической связи: ионной (гетерополярной) и ковалентной (гомеополярной).Ионная связь осуществляется благодаря кулоновскому притяжению между разноименно заряженными ионами (например, молекулы NaCl, КВг), а ковалентная – в результате обменного взаимодействия, носящего чисто квантовый характер и не имеющего аналога в классической физике (например, молекулы Н2, СО). Число атомов, составляющих молекулы, может быть от двух – двухатомные молекулы(Н2, СО, КС1) – до сотен и тысяч – многоатомные молекулы(белки, ...). Простейшая молекула с ковалентной связью – молекула водорода – состоит из двух протонов (ядер атома водорода) и двух электронов. Ковалентная связь объясняется принципом неразличимости тождественных частиц. Между двумя электронами (а они являются тождественными частицами) наблюдается обменное взаимодействие, возникающее как бы за счет обмена валентными электронами между двумя атомами. При сближении двух водородных атомов до расстояний порядка боровского радиуса возникает их взаимное притяжение и образуется устойчивая молекула водорода. Состояние молекулы как квантовой системы описывается уравнением Шредингера, учитывающим взаимодействие электронов с ядрами, электронов друг с другом, а также кинетическую энергию электронов и ядер. Для приближенного решения этой задачи используют адиабатное приближение, согласно которому квантово-механическая система разделяется на тяжелые и легкие частицы – ядра и электроны. Так как массы и скорости этих частиц сильно различаются, то считается, что движение электронов происходит в поле неподвижных ядер, а медленно движущиеся ядра находятся в усредненном поле электронов. Следовательно, в адиабатном приближении уравнение Шредингера для молекулы распадается на два уравнения – для электронов и ядер. Полная энергия молекулы без учета энергии поступательного движения и энергии ядер
 , (169)
, (169)
где Еэл – энергия, обусловленная движением электронов относительно ядер, Екол – энергия, обусловленная колебанием ядер (учитывает периодически изменяющееся относительное положение ядер), Eвр – энергия, обусловленная вращением ядер (учитывает периодически изменяющуюся ориентацию молекулы в пространстве). Каждая из входящих в выражение (169) энергий квантуется (ей соответствует набор дискретных уровней энергии) и определяется квантовыми числами. Отношения
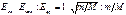 (170)
(170)
где т – масса электрона, М имеет порядок массы ядер; 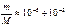 , поэтому
, поэтому 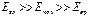 .
.
Приближенная квантовая модель молекулы – это совокупность далеко отстоящих друг от друга электронных уровней (различные Еэл при Екол = Евр = 0), довольно близко расположенных друг к другу колебательных уровней (заданное Еэл при различных Екол и Евр = 0) и еще более близких друг к другу вращательных уровней (заданные Еэл и Екол при различных Евр).
Дата добавления: 2015-02-25; просмотров: 1022;
