Сущность кислотно-основного титрования. Кривые титрования.
Метод кислотно-основного титрования (метод нейтрализации) – предназначен для определения концентрации кислот, оснований, солей и основан на реакции нейтрализации
Н+ + ОН- ↔ Н2О.
Реакции кислотно-основного взаимодействия являются реакциями передачи протона от титранта к определяемому веществу или наоборот; характеризуются высокой скоростью и протекают строго стехиометрически.
Так как реакция нейтрализации не сопровождается изменением окраски раствора, точку эквивалентности определяют с помощью индикатора. Но обычно индикаторы меняют окраску не строго в точке эквивалентности, а с некоторым отклонением от неё. Другими словами, конечная точка титрования, (момент, в который происходит изменение окраски индикатора) не совпадает с точкой эквивалентности, а только более или менее соответствует ей. Поэтому даже при правильном выборе индикатора допускается погрешность – так называемая индикаторная ошибка титрования. Неправильный же выбор индикатора может вообще исказить результаты титрования.
Индикаторы, применяемые в кислотно-основном титровании: кислотно-основные индикаторы, например, метиловый оранжевый, фенолфталеин и др.
Титранты кислотно-основного титрования: растворы сильных кислот при определении концентрации оснований, растворы щелочей при определении концентрации кислот.
Стандартные вещества: карбонат натрия Na2CO3, тетраборат натрия Na2B4O7∙10H2O для установления титра или нормальной концентрации (стандартизации) кислот. Щавелевая кислота Н2С2О4·2Н2О – для стандартизации щелочей.
Определяемые вещества: сильные и слабые кислоты; сильные и слабые основания; соли, подвергающиеся гидролизу.
Виды кислотно-основного титрования:
- титрование сильной кислоты сильным основанием или наоборот;
- титрование слабой кислоты сильным основанием;
- титрование слабого основания сильной кислотой.
Для правильного титрования, и, следовательно, получения верных результатов, необходимо правильно подобрать индикатор. Для этого следует знать:
- теорию индикаторов;
- как меняется рН раствора в колбе в ходе титрования, каково значение рН в точке эквивалентности и вблизи неё?
Для ответа на эти вопросы строят кривые титрования.
Кривая титрования – это график зависимости рН среды в колбе от объема добавленного титранта. Кривая титрования характеризуется точкой эквивалентности, точкой нейтральности, скачком титрования, линией нейтральности.
Линия нейтральности – прямая, параллельная оси абсцисс и пересекающая ось ординат при рН = 7.
Точка нейтральности – точка пересечения кривой титрования с линией нейтральности.
Скачок титрования – участок резкого изменения рН.
Титрование сильной кислоты сильным основанием (или наоборот). Расчет и построение кривой титрования. Для построения кривой титрования рассчитаем значения рН в точке эквивалентности и вблизи неё (когда добавлено титранта 0%, 90%, 99%, 99,9%, 100%, 100,1%, 101%, 110%, 200% от количества, необходимого для полной нейтрализации раствора в колбе) при титровании 10 мл 0,1н. раствора соляной кислоты 0,1н. раствором гидроксида натрия.
НСI + NaOH ↔ NaCI + H2O
По условию в колбе 10 мл 0,1н. раствор НСI, следовательно, в бюретке 0,1н. раствор NaOH.
По закону эквивалентов:
С(HCl) ∙V(HCl)=C(NaOH) ∙V(NaOH)
Следовательно, для полной нейтрализации 10 мл 0,1н. раствора НСI потребуется 10 мл 0,1н. раствора NaOH. По мере добавления к раствору кислоты, находящемуся в колбе, из бюретки раствора щелочи будет происходить постепенная нейтрализация соляной кислоты, причем 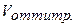 НСI =
НСI = 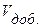 NaOH.
NaOH.
Объем добавленного титранта, в нашем случае объем добавленной щелочи, рассчитываем по формуле:
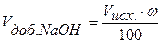 , (35)
, (35)
где ω – процент добавленного титранта.
Концентрация кислоты в колбе в процессе титрования будет меняться:
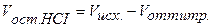 , (36)
, (36)
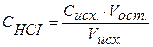 (37)
(37)
Точка №1: добавлено 0% NaOH, т.е. 0 мл. Концентрацию ионов Н+ в колбе рассчитываем по формуле (8), значение рН – по формуле (5):
[H+] = CHCI = 0,1 = 10-1,
рН = -lg[H+] = -lg10-1 = 1
Точка №2:добавлено 90% от объема щелочи, необходимого для нейтрализации кислоты. Объем добавленной щелочи рассчитываем по формуле (35):
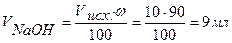 ,
,
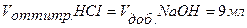 ,
,
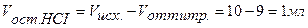 ,
,
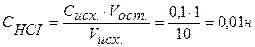 ,
,
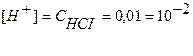 моль/л,
моль/л,
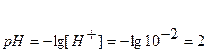
Аналогично рассчитываются точки №№ 3,4.
Точка №5–точка эквивалентности, так как добавлено эквивалентное количество щелочи (100%). Вся кислота в колбе оттитрована:
НСI + NaOH ↔ NaCI + H2O
В колбе находится раствор хлорида натрия. Данная соль гидролизу не подвергается. Как рассчитать рН? Концентрация ионов Н+ определяется диссоциацией воды:
Н2О ↔ Н+ + ОН-
Из формулы ионного произведения воды
[H+]·[OH-] = 10-14
следует:
[H+] = [OH-] = 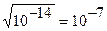 ,
,
pH = - lg [H+] = - lg 10-7 = 7.
Таким образом, при титровании сильной кислоты сильным основанием (или наоборот) точка эквивалентности совпадает с точкой нейтральности.
Точка №6:теоретически продолжаем титрование, чтобы построить график и подобрать индикатор. Добавляем 100,1% от необходимого объема щелочи, следовательно, в колбе избыток щелочи.
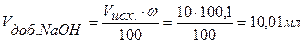 ,
,
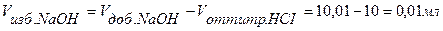 .
.
Находим концентрацию щелочи в колбе по формуле:
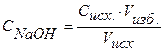 , (38)
, (38)
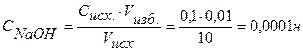 .
.
Концентрацию гидроксид-ионов рассчитываем по формуле (12), для расчета концентрации ионов Н+ в щелочном растворе используем формулу (4):
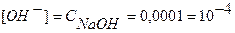 моль/л,
моль/л,
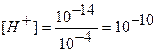 моль/л,
моль/л,
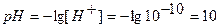 .
.
Аналогично рассчитывают точки №№ 7,8,9. Данные расчетов заносим в таблицу.
Далее строим график зависимости: рН = f (Vтитранта, %). На графике отмечаем точку эквивалентности, скачок титрования, линию нейтральности.
| № точки | Добавлено щелочи | От-титро-вано к-ты, мл | Vост. к-ты, мл | Хар-р среды р-ра в колбе | 
| [H+] | рН | |
| % | мл | |||||||
| кислая | C = 0,1 н. | 10-1 | ||||||
| кислая | C = 0,01н. | 10-2 | ||||||
| 9,9 | 9,9 | 0,1 | кислая | С = 0,001н. | 10-3 | |||
| 99,9 | 9,99 | 9,99 | 0,01 | кислая | С = 0,0001н. | 10-4 | ||
| нейтр. | определяется диссоциацией воды [H+]·[OH-] = 10-14 | 10-7 | ||||||
| Vизб. щелочи, мл | 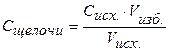
| |||||||
| 100,1 | 10,01 | 0,01 | щелоч | C = 0,0001н. | 10-10 | |||
| 10,1 | 0,1 | щелоч | С = 0,001н. | 10-11 | ||||
| щелоч | С = 0,01н. | 10-12 | ||||||
| щелоч | С = 0,1н. | 10-13 |
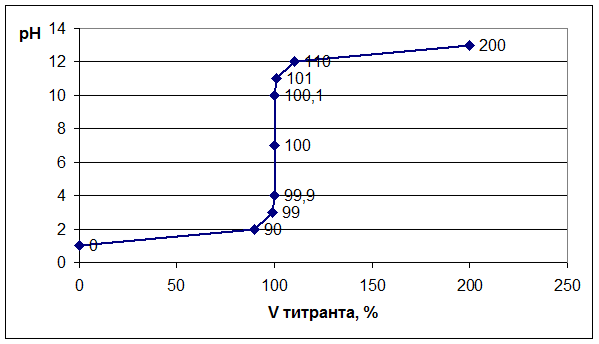
График: Титрование сильной кислоты сильным основанием.
Следует отметить, что при титровании сильного основания сильной кислотой рН раствора в колбе будет меняться в обратном направлении, то есть от 14 до 0.
Выбор индикатора. Каждый индикатор изменяет свою окраску в определенном диапазоне значений рН – это так называемая область перехода. Показатель титрования индикатора (рТ) – это значение рН, при котором наблюдатель отчетливо отмечает изменение окраски раствора и признает титрование оконченным. Индикатор подбирают таким образом, чтобы его показатель титрования рТ был как можно ближе к значению рН в точке эквивалентности.
Для нашего случая (см. Приложение VII) подойдут следующие индикаторы: метиловый оранжевый, метиловый красный, лакмус, фенолфталеин.
Титрование слабой кислоты сильным основанием.В качестве примера рассмотрим титрование уксусной кислоты гидроксидом натрия:
СН3СООН + NaOH → СН3СООNa + Н2О
Ацетат натрия подвергается гидролизу:
СН3СОО- + Н2О → СН3СООН + ОН-.
В результате образования некоторого избытка гидроксид-ионов точка эквивалентности не совпадает с точкой нейтральности, а лежит в щелочной области. Следовательно, имеет место сужение скачка титрования в кислотной области. Для данного вида кислотно-основного титрования подходит индикатор фенолфталеин.
Титрование слабого основания сильной кислотой.В качестве примера рассмотрим титрование гидроксида аммония соляной кислотой:
NH4OH + HCI → NH4CI + H2O
Хлорид аммония подвергается гидролизу:
NH4+ + H2O → NH4OH + H+
В результате образования некоторого избытка ионов Н+ точка эквивалентности лежит в кислотной области. Следовательно, имеет место сужение скачка титрования в щелочной области. Для данного вида кислотно-основного титрования подходят индикаторы метиловый оранжевый, метиловый красный.
Титрование слабой кислоты слабым основанием (и наоборот)невозможно, так как наблюдается сужение скачка титрования и в кислотной, и щелочной области. Скачок титрования исчезает на кривой титрования. Следовательно, не может быть резкого изменения окраски индикатора.
Индикаторы кислотно-основного титрования.Ионная теория индикаторов.Индикаторы в методе кислотно-основного титрования представляют собой слабые органические кислоты НInd или слабые органические основания IndOH, у которых молекулярная и ионная формы имеют различную окраску.
Примером кислотного индикатора НInd является фенолфталеин, его молекулы бесцветны, а анионы Ind- имеют малиновую окраску. Согласно ионной теории индикаторов изменение цвета индикатора вызывается смещением равновесия в уравнении диссоциации:
НInd ↔ H+ + Ind-
бесцветная малиновая
Если к раствору, содержащему фенолфталеин, прибавить немного щелочи, ионы ОН- будут связывать ионы Н+ с образованием слабого электролита Н2О и равновесие смещается в сторону образования анионов Ind-, раствор окрасится в малиновый цвет. Если же добавить к раствору фенолфталеина немного кислоты, то повышение концентрации протонов вызовет смещение равновесия в сторону недиссоциированных молекул индикатора и раствор станет бесцветным.
Ионно-хромофорная теория.Молекулы индикаторов содержат хромофоры (носители цветности). Это особые группы атомов с сопряженными двойными связями и неподеленными электронными парами (– N ≡ N –, – N = O, =C=O, = = ).





 Изменение окраски индикатора происходит при превращении одних хромофоров в другие у двухцветных индикаторов и при появлении и исчезновении хромофоров у одноцветных индикаторов. Другими словами, кислотно-основные индикаторы могут существовать в двух взаимно переходящих формах, имеющих различную окраску. Переход происходит под действием ионов Н+ или ОН-. На окраску индикаторов оказывают влияние также ауксохромы. Это содержащиеся в их молекулах группы -ОН, –NH2 и их производные ( – ОСН3, –N(CH3)2 и т.п.), которые в отличие от хромофоров не сообщают окраску, а усиливают их действие, повышая интенсивность вызываемой ими окраски.
Изменение окраски индикатора происходит при превращении одних хромофоров в другие у двухцветных индикаторов и при появлении и исчезновении хромофоров у одноцветных индикаторов. Другими словами, кислотно-основные индикаторы могут существовать в двух взаимно переходящих формах, имеющих различную окраску. Переход происходит под действием ионов Н+ или ОН-. На окраску индикаторов оказывают влияние также ауксохромы. Это содержащиеся в их молекулах группы -ОН, –NH2 и их производные ( – ОСН3, –N(CH3)2 и т.п.), которые в отличие от хромофоров не сообщают окраску, а усиливают их действие, повышая интенсивность вызываемой ими окраски.
▼ Индивидуальные задания
Рассчитать значения рН в точке эквивалентности и вблизи нее и построить кривую титрования:
| № варианта | Условие |
| 20 мл 0,01н. раствора НNO3 0,01н. раствором NaOH | |
| 20 мл 0,1н. раствора NaOH 0,1н. раствором НNO3 | |
| 30 мл 0,01н. раствора НNO3 0,01н. раствором NaOH | |
| 30 мл 0,1н. раствора КОН 0,1н. раствором НNO3 | |
| 40 мл 0,01н. раствора NaOH 0,01н. раствором НСI | |
| 40 мл 0,1н. раствора НСI 0,1н. раствором КОН | |
| 60 мл 0,1н. раствора НNO3 0,1н. раствором NaOH | |
| 60 мл 0,01н. раствора КОН 0,01н. раствором НСI | |
| 70 мл 0,01н. раствора НNO3 0,01н. раствором NaOH | |
| 70 мл 0,1н. раствора КОН 0,1н. раствором НNO3 | |
| 80 мл 0,1н. раствора НСI 0,1н. раствором КОН | |
| 80 мл 0,01н. раствора КОН 0,01н. раствором НNO3 | |
| 20 мл 1н. раствора НСI 1н. раствором КОН | |
| 20 мл 1н. раствора NaOH 1н. раствором НСI | |
| 100 мл 0,01н. раствора НСI 0,01н. раствором NaOH | |
| 100 мл 0,1н. раствора NaOH 0,1н. раствором НNO3 | |
| 10 мл 1н. раствора НNO3 1н. раствором КОН |
▲ Обучающие задачи
Задача №1
Титр раствора НСI равен 0,00359 г/мл. Найти молярную концентрацию эквивалента раствора соляной кислоты.
 Дано: Решение:
Дано: Решение:
 Т(НСI) = 0,00359г/мл
Т(НСI) = 0,00359г/мл 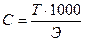
С - ? Э (НCI) = 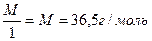
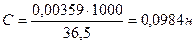
Ответ: С (НСI) = 0,0984н.
Задача №2
Какова молярная концентрация эквивалента и титр раствора щавелевой кислоты (Н2С2О4∙2Н2О), полученного растворением 1,7334 г её в мерной колбе ёмкостью 250 мл?
 Дано: Решение:
Дано: Решение:
m (Н2С2О4 ∙ 2Н2О) = 1,7334г 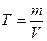

 Vколбы = 250 мл Т (Н2С2О4 ∙ 2Н2О) =
Vколбы = 250 мл Т (Н2С2О4 ∙ 2Н2О) = 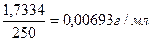
С - ? Т - ? 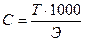
Э (Н2С2О4 ∙ 2Н2О) = 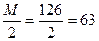
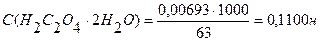
Ответ: С (Н2С2О4 ∙ 2Н2О) = 0,1100н.
Задача №3
На титрование 20 мл раствора НNO3 израсходовано 18,25 мл 0,1103н. раствора NaOH. Вычислить молярную концентрацию эквивалента раствора НNO3.
 Дано: Решение:
Дано: Решение:
V(НNO3) = 20мл С(НNO3) · V(HNO3) = C(NaOH) ∙ V(NaOH)
С(NaOH) = 18,25мл
 С(NaOH) = 0,1103н.
С(NaOH) = 0,1103н. 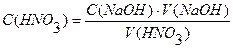
С (НNO3) - ? 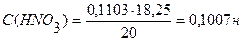
Ответ: С(НNO3) = 0,1007н.
Задача №4
Вычислить нормальность и титр соляной кислоты, если на титрование 10,0 мл раствора Na2CO3, полученного растворением навески 0,4993г в мерной колбе ёмкостью 100мл, расходуется 11,2 мл раствора НСI.
 Дано: Решение:
Дано: Решение:
m(Na2CO3)=0,4993г С(НСI) ∙ V (HCI) = C(Na2CO3) ∙ V(Na2CO3)
Vколбы = 100 мл 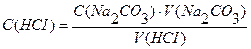
V(Na2CO3) = 10,0 мл 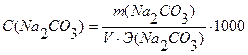
 V(HCI) = 11,2 мл
V(HCI) = 11,2 мл 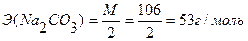
С(НСI) - ? 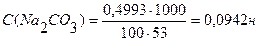
Т(НСI) - ? 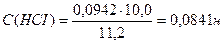
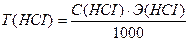
Э(НСI) = М = 36,5 г/моль
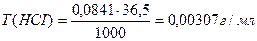
Ответ: С(НСI) = 0,0841н., Т(НСI) = 0,00307 г/мл.
▼ Задачи для самостоятельного решения
1. Титр раствора азотной кислоты равен 0,00609 г/мл. Найти молярную концентрацию эквивалента кислоты. Ответ: 0,0967н.
2. Рассчитать величину навески Н2С2О4∙2Н2О для приготовления 100мл 0,1н. раствора. Ответ: 0,63г.
3. Какова молярная концентрация эквивалента и титр раствора Na2CO3, полученного растворением: а) навески 1,0678г в мерной колбе емкостью 200 мл; б) навески 0,4968г в мерной колбе емкостью 100 мл; в) навески 0,5265г в мерной колбе емкостью 100 мл? Ответы: а) Т = 0,00534 г/мл, С = 0,1008н; б) Т = 0,00497 г/мл, С = 0,0938н; в) Т = 0,00527 г/мл, С = 0,0994 н.
4. На титрование 10,00 мл раствора NaOH израсходовано 9,15 мл 0,0981н. раствора НСI. Вычислить молярную концентрацию эквивалента гидроксида натрия. Ответ: 0,0898н.
5. На титрование 10,00 мл 0,0915н. раствора Na2CO3 израсходовано 10,2 мл раствора НСI. Вычислить молярную концентрацию эквивалента раствора HCI. Ответ: 0,0897н.
6. На титрование 10,00 мл 0,1041н. раствора Na2CO3 израсходовано 8,9 мл раствора НСI. Вычислить нормальность раствора HCI. Ответ: 0,1170н.
7. На титрование 10,00 мл раствора NaOH израсходовано 8,75 мл 0,1055н. раствора НСI. Вычислить молярную концентрацию эквивалента NaOH. Ответ: 0,0923н.
8. Какой объем 0,0965н. раствора NaOH пойдет на титрование 10 мл 0,1105н раствора НСI? Ответ: 11,45 мл.
9. Какой объем 0,0991н раствора НСI пойдет на титрование 10 мл 0,1025н раствора NaOH? Ответ: 10,34 мл.
10. Вычислить нормальность и титр раствора соляной кислоты, если на титрование 20,00 мл раствора Na2CO3, полученного растворением навески 0,9985г в мерной колбе емкостью 200 мл, расходуется 24 мл раствора НСI. Ответ: С = 0,0785н., Т = 0,00287 г/мл.
11. Вычислить нормальность раствора НСI, если на титрование 10,00 мл раствора Na2CO3, полученного растворением навески 0,5502г в мерной колбе емкостью 100 мл, расходуется 9,75 мл раствора НСI. Ответ: С = 0,1065н.
? Контрольные вопросы
1. Сущность титриметрического анализа. Что такое титрование, точка эквивалентности? Способы установления точки эквивалентности.
2. Способы выражения концентрации растворов в титриметрическом анализе. Приведите соответствующие формулы.
3. Что лежит в основе классификации методов титриметрического анализа. Кратко охарактеризуйте каждый метод. Применение титриметрического анализа.
4. Стандартные и стандартизированные растворы. Требования, предъявляемые к стандартным веществам. Стандартные и стандартизированные растворы в кислотно-основном титровании. Приведите примеры. Формулы расчета массы вещества для приготовления стандартного раствора, расчета титра и нормальной концентрации стандартного раствора, расчета концентрации стандартизированного раствора.
5. Сущность кислотно-основного титрования. Что такое точка эквивалентности? В какой области значений рН лежит точка эквивалентности при титровании: а) сильной кислоты сильным основанием (или наоборот); б) слабой кислоты сильным основанием; в) слабого основания сильной кислотой? Привести примеры и объяснить. Объяснить, возможно ли титрование слабой кислоты слабым основанием.
6. Выбор индикатора в кислотно-основном титровании. Что такое область перехода и показатель титрования индикатора? Ионная теория индикаторов на примере фенолфталеина.
7. Ионно-хромофорная теория индикаторов. Понятие о хромофорах и ауксохромах.
Дата добавления: 2015-02-13; просмотров: 20999;
