Окислительно-восстановительное титрование
Данный метод титриметрического анализа основан на окислительно-восстановительных реакциях между титрантом и анализируемым веществом. Реакции окисления-восстановления связаны с переносом электронов. Вещества, отдающее электроны, в этих реакциях является восстановителем (Red), а приобретающее электроны – окислителем (Ох):

Red1 + Ox2 = Ox1 + Red2.
Восстановленная форма одного вещества (Red1), отдавая электроны, переходит в окисленную форму (Ox1) того же вещества. Образуется сопряженная окислительно-восстановительная пара Ox1/Red1 (редокс-пара). Окисленная форма другого вещества (Ox2), принимая электроны, переходит в восстановленную форму (Red2) того же вещества. Образуется другая окислительно-восстановительная пара Ox2 /Red2. Таким образом, в окислительно-восстановительной реакции участвует не менее двух окислительно-восстановительных пар. Мерой окислительно-восстановительных свойств веществ является окислительно-восстановительный потенциал Е0. Сравнивая стандартные потенциалы ОВ-пар, участвующих в ОВР, можно заранее определить направление самопроизвольного протекания реакции. Окислительно-восстановительная реакция самопроизвольно протекает в направлении превращения сильного окислителя в слабый восстановитель, сильного восстановителя в слабый окислитель.
Чем больше стандартный потенциал окислительно-восстановительной пары, тем более сильным окислителем является её окисленная форма и тем более слабым восстановителем – восстановленная форма. Чем меньше стандартный потенциал ОВ-пары, тем более сильным восстановителем является восстановленная форма, тем более слабым окислителем – окисленная форма. Поэтому в окислительно-восстановительном титровании (редоксиметрии) в качестве титрантов при определении восстановителей применяют такие окислители (Ох2), стандартные ОВ-потенциалы окислительно-восстановительных пар которых имеют как можно более высокие значения, тем самым с их помощью можно оттитровать большее число восстановителей (Red1). Например, Е0 (MnO4-, H+, Mn2+) = +1,51В, Е0 (Cr2O72-, H+, Cr3+) = +1,33В и др.
При определении окислителей (Ох2) в качестве титрантов применяют восстановители (Red1), стандартный ОВ-потенциал редокс-пар которых имеет по возможности минимальное значение. Например, Е0 (I2 / 2I-) = +0,536В, Е0 (S4O62- / 2S2O32-) = +0,09В и др.
Для установления точки эквивалентности в редоксиметрии используют редокс-индикаторы (окислительно-восстановительные индикаторы), представляющие собой вещества, способные обратимо окисляться и восстанавливаться, причем окисленная и восстановленная формы их имеют различную окраску. Примером такого индикатора является дифениламин. Часто в редоксиметрии применяется так называемое безиндикаторное титрование, например, в перманганатометрии роль индикатора выполняет титрант – перманганат калия. Количественные расчеты в ОВ титровании, как и в других методах титриметрического анализа, основаны на законе эквивалентов.
Молярная масса эквивалента окислителя:
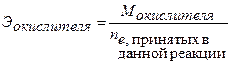 (39)
(39)
Молярная масса эквивалента восстановителя:
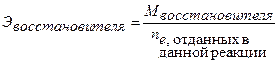 (40)
(40)
Одним из методов окислительно-восстановительного титрованияявляется перманганатометрическое титрование.Это метод анализа, в котором в качестве титранта-окислителя используют раствор перманганата калия KMnO4. Анион MnO4- проявляет окислительные свойства в кислой, нейтральной и щелочной средах, восстанавливаясь соответственно до катиона Mn2+ (бесцветные ионы), оксида марганца (IV) MnO2 (бурый осадок) и аниона MnO42- (зеленый раствор, буреющий на воздухе).
Уравнения полуреакций:
- кислая среда
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
E0 (MnO4-, H+,Mn2+) = +1,51В
-нейтральная среда
MnO4- + 2H2O + 3e- → MnO2↓ + 4OH-
E0 (MnO4-/MnO2) = + 0,60В
-щелочная среда
MnO4- + e- → MnO42-
E0 (MnO4-/MnO42-) = + 0,56В
В перманганатометрии титрование проводят в кислой среде, так как:
1) наиболее сильными окислительными свойствами перманганат-ион MnO4- обладает в кислой среде по сравнению с нейтральной и щелочной, о чем свидетельствуют значения стандартных ОВ-потенциалов (+1,51В против +0,60В и +0,56В);
2) определению конечной точки титрования в нейтральной среде будет мешать бурый осадок MnO2; в щелочной среде образующиеся манганат-ионы MnO42-, имеющие зеленую окраску, также затрудняют фиксацию конечной точки титрования. Образующиеся же в кислой среде катионы Mn2+ бесцветны;
3) при титровании в кислой среде создается возможность четко фиксировать конечную точку титрования без применения постороннего индикатора, так как одна лишняя капля перманганата калия окрашивает бесцветный раствор в бледно-розовый цвет.
Титрант: раствор перманганата калия (в кислой среде).
Индикатор: перманганат калия.
Определяемые вещества: ионы Fe2+, Cr3+, NO2-, перекись водорода Н2О2, этиловый спирт, в биологических исследованиях мочевая кислота, глюкоза, содержание некоторых витаминов, активность фермента каталазы, окисляемость бытовых и сточных вод, органические загрязнения в атмосфере.
Одним из недостатков перманганатометрии является необходимость стандартизации раствора перманганата калия, так как его титрованный раствор нельзя приготовить по точной навеске. Кроме того, концентрация перманганата калия, переведенного в раствор, заметно уменьшается. Поэтому точную концентрацию раствора КMnO4 устанавливают не ранее чем через 5 – 7 дней после его приготовления. Для стандартизации используют щавелевую кислоту или её соли (оксалаты натрия или аммония).
Стандартные вещества: Н2С2О4·2Н2О, Na2C2O4, (NH4)2C2O4∙H2O.
Уравнение реакции, протекающей при стандартизации раствора KMnO4 по щавелевой кислоте:
Н2С2О4 + КMnO4 + H2SO4 → CO2↑ + Mn2+ + …
 C2O42- – 2e- → 2CO2 5
C2O42- – 2e- → 2CO2 5
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O 2

5C2O42- + 2MnO4- + 16H+ → 10CO2↑ + 2Mn2+ + 8H2O
10H+ 2K+ 3SO42- 2K+ 3SO42-

5H2C2O4 + 2KMnO4 + 3H2SO4 = 10CO2↑ + 2MnSO4 + K2SO4 + 8H2O
Дата добавления: 2015-02-13; просмотров: 3145;
