Определения, формулы
Это метод количественного анализа, основанный на точном измерении объема раствора реактива, израсходованного на реакцию с определяемым компонентом.
В титриметрическом анализе применяют титрованные растворы, или титранты, титр которых точно известен.
Титр является наиболее точным способом выражения концентрации раствора. Под титром понимают количество граммов вещества, содержащееся в 1 мл раствора (г/мл):
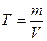 (23)
(23)
Наряду с титром в титриметрическом анализе используют еще один способ выражения концентрации раствора – это молярная концентрация эквивалента, под которой понимают отношение количества вещества эквивалента в растворе к объему раствора:
 (24)
(24)
Единица измерения – моль/л. После численного значения обычно применяют сокращенное «н». Например, 1н., 0,1н. раствор.
Для расчета молярной концентрации эквивалента (нормальности) раствора следует знать молярную массу эквивалента Э. Молярную массу эквивалента кислот, оснований и солей рассчитывают по формулам:
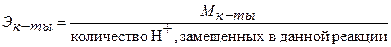 , (25)
, (25)
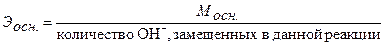 , (26)
, (26)
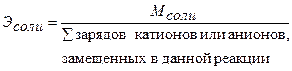 (27)
(27)
Титрование – это процесс постепенного приливания титранта к анализируемому раствору. При титровании используют не избыток реактива (как в гравиметрическом анализе), а количество его, точно соответствующее уравнению реакции и химически эквивалентное количеству анализируемого вещества. Поэтому в ходе титрования важно установить момент окончания реакции, или точку эквивалентности, в которой согласно закону эквивалентов количество титранта равно количеству анализируемого вещества. По достижении точки эквивалентности титрование прекращают.
Сущность титриметрического анализа можно выразить формулой:
C1∙V1=C2∙V2 , (28)
где С1 – молярная концентрация эквивалента титранта; С2 – молярная концентрация эквивалента анализируемого раствора; V1 и V2 – соответственно их объемы.
Точку эквивалентности в титриметрическом анализе устанавливают по изменению окраски индикатора.
Индикаторы – это вещества, изменяющие свою окраску при определенных значениях рН.
По типу используемой реакции, различают следующие методы титриметрического анализа:
- кислотно-основное;
- осадительное;
- комплексонометрическое;
- окислительно-восстановительное титрование.
В зависимости от способа получения титрованные растворы делят на стандартные (приготовленные) и стандартизированные (установленные).
Стандартных веществ немного, они должны удовлетворять определенным требованиям. Их готовят по точной навеске. По стандартному веществу затем устанавливают концентрацию стандартизированного раствора.
Точность титриметрического анализа зависит от следующих факторов:
- точности измерения объемов реагирующих веществ;
- правильности и точного приготовления стандартных веществ и титрантов;
- правильного выбора индикатора.
Дата добавления: 2015-02-13; просмотров: 1692;
