Лекция 9 Основы термодинамики
1. Первое начало термодинамики. Изопроцессы. Цикл Карно и его КПД.
2. Второе начало термодинамики и его физический смысл. Статистическое толкование второго начала термодинамики.
Тезисы
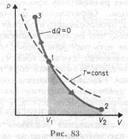
1. Работа А/, совершаемая внешними телами над системой, численно равна и противоположна по знаку работе А, совершаемой самой системой над внешней средой: 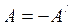 Полная работа, совершаемая газом при изменении его объема от V1 до V2
Полная работа, совершаемая газом при изменении его объема от V1 до V2 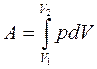 определяется площадью, ограниченной осью абсцисс, кривой p = f(V) и прямыми V1 и V2.
определяется площадью, ограниченной осью абсцисс, кривой p = f(V) и прямыми V1 и V2.
Первый закон термодинамики: Теплота, сообщенная системе, идет на приращение внутренней энергии и совершение работы системой над внешними телами 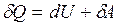 , где dU - бесконечно малое изменение внутренней энергии системы, δA - элементарная работа, δQ - бесконечно малое количество теплоты. Первое начало термодинамики для 1 моль газа:
, где dU - бесконечно малое изменение внутренней энергии системы, δA - элементарная работа, δQ - бесконечно малое количество теплоты. Первое начало термодинамики для 1 моль газа: 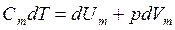 Молярная теплоемкость при постоянном объеме равна изменению внутренней энергии 1 моль газа при повышении его температуры на 1 К
Молярная теплоемкость при постоянном объеме равна изменению внутренней энергии 1 моль газа при повышении его температуры на 1 К 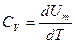
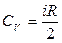
Молярная теплоемкость при постоянном давлении 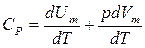

Уравнение Майера 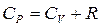 или
или 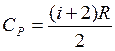
Уравнение адиабаты (уравнение Пуассона) 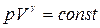 Показатель адиабаты, или коэффициент Пуассона
Показатель адиабаты, или коэффициент Пуассона 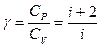 Уравнение политропы
Уравнение политропы 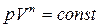 Показатель политропы
Показатель политропы 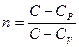 (при С = 0, n = g - уравнение адиабаты; при С = ¥, n = 1 - уравнение изотермы; при С = СР, n = 0 - уравнение изобары; при С = Сv, n = ±¥ - уравнение изохоры).
(при С = 0, n = g - уравнение адиабаты; при С = ¥, n = 1 - уравнение изотермы; при С = СР, n = 0 - уравнение изобары; при С = Сv, n = ±¥ - уравнение изохоры).
Применение первого начала термодинамики к изопроцессам
| Величина | Процесс | |||
| Изотермический T = const | Изобарный P = const | Изохорный V = const | Адиабатный
| |
| Работа | 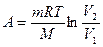 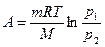
| 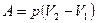
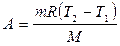
| A = 0 | 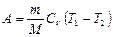 Работа газа меньше, чем при изотермическом
Работа газа меньше, чем при изотермическом
|
| Первое начало термоди-намики | 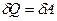 Все количество теплоты, подводимое газу, расходуется на совершение им работы против внешних сил
Все количество теплоты, подводимое газу, расходуется на совершение им работы против внешних сил
|
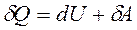
| 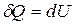 Теплота, сообщаемая газу, идет на увеличе-ние его внутрен-ней энергии
Теплота, сообщаемая газу, идет на увеличе-ние его внутрен-ней энергии
| 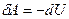 Работа совершается за счет изменения внутренней энергии системы
Работа совершается за счет изменения внутренней энергии системы
|
| Теплота | 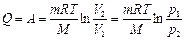
|
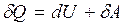
| 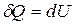
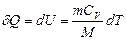
|
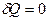
|
| Изменение внутрен-ней энергии | 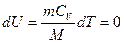 Внутренняя энергия
не меняется
Внутренняя энергия
не меняется
| 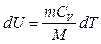
| 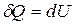
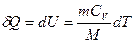
| 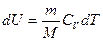
|
Термический коэффициент полезного действия для кругового процесса 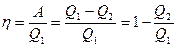 , где Q1— количество теплоты, полученное системой, q2— количество теплоты, отданное системой.
, где Q1— количество теплоты, полученное системой, q2— количество теплоты, отданное системой.
2. Приведенное количество теплоты - отношение теплоты Q, полученной телом в изотермическом процессе, к температуре Т теплоотдающего тела, dQ / T.
Приведенное количество теплоты, сообщаемое телу в любом обратимом круговом процессе, равно нулю: 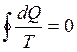 или
или 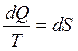 Функция состояния, дифференциалом которой является dQ/T, называется энтропией и обозначается S.
Функция состояния, дифференциалом которой является dQ/T, называется энтропией и обозначается S.
Неравенство Клаузиуса 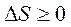 Энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Изменение энтропии DS1®2 идеального газа при переходе его из состояния 1 в состояние 2 не зависит от вида процесса перехода: 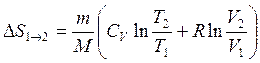
Адиабатический обратимый процесс протекает при постоянной энтропии.
При изотермическом процессе 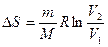 , при изохорном
, при изохорном 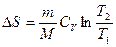
Термодинамическая вероятностьW состояния системы — это число способов, которыми может быть реализовано данное состояние макроскопической системы.
Формула Больцмана 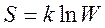 (энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние).
(энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние).
Статистическое толкование энтропии Энтропия является мерой неупорядоченности системы. Процессы в замкнутой системе идут в направлении от менее вероятных состояний к более вероятным, до тех пор, пока вероятность состояния не станет максимальной. Энтропия и термодинамическая вероятность состояний замкнутой системы могут либо возрастать (в случае необратимых процессов), либо оставаться постоянными (в случае обратимых процессов). Эти утверждения выполняются в системах, состоящих из очень большого числа частиц. Энтропия пропорциональна вероятности пребывания системы в определенном состоянии. Наиболее вероятным состоянием системы, состоящей из большого числа частиц, будет состояние, когда все частицы равномерно распределены по всему объему системы, т.е. они распределены хаотически. Поэтому возрастание энтропии означает, что любая система стремится в состояние с наибольшей вероятностью. Другими словами, наиболее вероятным состоянием системы является состояние полного хаоса.
Формулировки второго начала термодинамики
1. любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает;
2. невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу;
3. невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
Третье начало термодинамики (теорема Нернста — Планка): энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к абсолютному нулю: 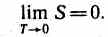
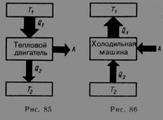
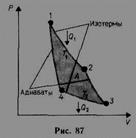
Теорема Карно: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (T1) и холодильников (Т2), наибольшим к. п. д. обладают обратимые машины; при этом КПД обратимых машин, работающих при одинаковых температурах нагревателей (T1) и холодильников (T2), равны друг другу и не зависят от природы рабочего тела (тела, совершающего круговой процесс и обменивающегося энергией с другими телами). Цикл Карно – обратимый, наиболее экономичный цикл, состоящий из двух изотерм и двух адиабат
КПД цикла Карно 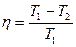
Дата добавления: 2015-01-29; просмотров: 1631;
