ЛАБОРАТОРНАЯ РАБОТА № 4.определение теплоты гидратации сульфата меди (II)
Цель: познакомиться с законом Гесса и используя его, определить тепловой эффект гидратации безводного сульфата меди (II).
Теоретическая часть
Как известно, большинство химических реакций сопровождаются выделением (экзотермические реакции) либо поглощением (эндотермические реакции) теплоты. Первое начало термодинамики дает возможность рассчитать тепловой эффект химической реакции при различных условиях её проведения.
Тепловой эффект (теплота) химической реакции– количество теплоты, выделившейся либо поглотившейся в ходе реакции. Уравнения процессов, в которых указаны тепловые эффекты, называютсятермохимическими.
Чтобы отнести тепловой эффект или энтальпию реакции к 1 молю какого-либо вещества, термохимические уравнения иногда имеют дробные коэффициенты:
2 Al+ 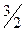 O2=Al2O3 + 1675,8 кДж/моль или
O2=Al2O3 + 1675,8 кДж/моль или
2 Al+ 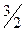 O2=Al2O3
O2=Al2O3 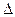 H0298= -1675,8 кДж/моль
H0298= -1675,8 кДж/моль
Тепловые эффекты, сопровождающие протекание химических реакций, являются предметом одного из разделов химической термодинамики – термохимии. Долгое время тепловой эффект было принято обозначать буквой Q. В настоящее время тепловой эффект принято обозначать ∆H. H – энтальпия системы, мера энергии, накапливаемой веществом при его образовании. При экзотермических реакциях тепло выделяется, при этом энтальпия системы уменьшается. В случае эндотермических реакций теплота поглощается, следовательно, энтальпия увеличивается. Очевидно Q = - ∆H.
Теплота образования вещества – тепловой эффект реакции образования 1 моля сложного вещества из простых. Теплоты образования простых веществ принимаются равными нулю.
Теплота сгорания вещества – тепловой эффект реакции окисления 1 моля вещества в избытке кислорода до высших устойчивых оксидов.
Теплота растворения – тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. Теплота растворения складывается из двух составляющих: теплоты разрушения кристаллической решетки (для твердого вещества) и теплоты сольватации:
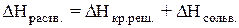
Поскольку ΔНкр.реш. всегда положительно (на разрушение кристаллической решетки необходимо затратить энергию), а ΔНсольв. всегда отрицательно, знак
ΔНраств. определяется соотношением абсолютных величин ΔНкр.реш. и ΔНсольв.:
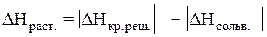
Основным законом термохимии является закон Гесса, являющийся частным случаем первого начала термодинамики:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Изменение энтальпии ΔН (тепловой эффект изобарного процесса Qp) и изменение внутренней энергии ΔU(тепловой эффект изохорного процесса Qv) не зависят от пути, по которому система переходит из начального состояния в конечное.
Экспериментальная часть
Работа проводится в калориметрической установке. В качестве калориметра используется сухой пластмассовый стакан с теплозащитной оболочкой (термос), мешалка и термометр. В калориметрический стакан налить 100 мл дистиллированной воды и, выждав 5-7 минут, измерить ее температуру с точностью до 0,1оС (t1). Получить у преподавателя навеску безводного сульфата меди (II) (массой 3 грамма), насыпать соль в стакан, растворить ее при перемешивании мешалкой, отметить максимальную температуру(t2).
Расчеты суммарной теплоты гидратации и растворения безводного сульфата меди (II) вести в следующей последовательности:
1) Вычислить величину изменения температуры: ∆t  = t2 – t1
= t2 – t1
2) Вычислить массу раствора: m = mсоли + mводы. Массу воды рассчитать, учитывая, что плотность воды равна 1 г/см3
3) Вычислить количество теплоты, затраченной на растворение сульфата меди (II) по формуле:
q1 = c ∙ ۬۬۬m ∙ ∆t,
где с – удельная теплоемкость (принять равной 4,184 Дж/( г.К).
4) Пересчитать тепловой эффект растворения безводного сульфата q1 на 1 моль вещества Q1.
После этого повторить опыт, взяв медный купорос CuSO4 ∙ 5Н2О в количестве 5 г. Опыт и расчеты провести так же, как с безводным сульфатом меди. В этом опыте определить теплоту растворения медного купороса q2. Пересчитать на 1 моль кристаллогидрата Q2 и определить теплоту гидратации по разности теплот растворения безводной соли и кристаллогидрата, пересчитанных на 1 моль вещества: Qгидратации = Q1 - Q2. Все результаты и проведенные расчеты записать в таблицу 1.
Таблица 1 - Результаты определения теплоты гидратации
| Вещество | Мас-са, г | Темпера-тура, С | Вычислен-ная теплота, Дж | Пересчитан-ная теплота Дж/моль | Теплота гидратацииДж | ||||
| t2 | t2 | q1 | q2 | Q1 | Q2 | Qгидратации | |||
| CuSO4 | |||||||||
| CuSO4 ∙ 5Н2О | |||||||||
Контрольные вопросы
1) Какие расчеты можно проводить на основе закона Гесса?
2) Как используя теплоты образования рассчитать тепловой эффект реакции?
3) Как используя теплоты сгорания рассчитать тепловой эффект реакции?
4) Что такое теплота растворения и гидратации?
5) Как связаны между собой тепловой эффект реакции и энтальпия?
5 ЛАБОРАТОРНАЯ РАБОТА № 5. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Цель: Экспериментально изучить зависимость скорости протекания химических реакций от концентрации, температуры и катализатора.
Дата добавления: 2015-01-21; просмотров: 2937;
