ЛАБОРАТОРНАЯ РАБОТА № 6. Химическое равновесие. Смещение химического равновесия
Цель: Изучить количественные характеристики химического равновесия и факторы, влияющие на его смещение.
Теоретическая часть
Константа химического равновесия. При равновесии химической реакции:
dD + bB ↔ lL + mM
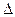 G0= - RTln (P
G0= - RTln (P 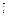 p,L P
p,L P 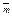 p,M / P
p,M / P 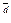 p,D P
p,D P  p,B )
p,B )
или
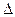 G0= - RTln
G0= - RTln 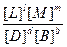 ,
,
где 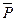 P,L,
P,L, 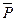 P,M ,
P,M , 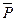 P,D,
P,D, 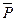 P,B –равновесные относительные парциальные давления соответствующих веществ;
P,B –равновесные относительные парциальные давления соответствующих веществ;
[L], [M], [D], [B] – равновесные концентрации соответствующих веществ.
Константа химического равновесия может выражаться через равновесные концентрации или парциальные давления:
Кр= 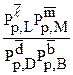 , или Кс=
, или Кс= 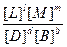
Таким образом, константа химического равновесия равна:
Отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ, в степенях, равных стехиометрическим коэффициентам, при постоянной температуре.
Принцип Ле Шателье.При внешнем воздействии на систему происходит смещение химического равновесия, т.е. изменяются равновесные концентрации исходных веществ и продуктов реакции. Характер смещения можно прогнозировать, применяя принцип Ле Шателье:
Если на систему находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие.
1) Влияние концентраций (парциальных давлений) компонентов.
Рассмотрим реакцию:
СН4 + 2Н2О ↔ СО2 + 4Н2
Если в систему добавить метан, то равновесие системы нарушается.
При этом ускоряется прямая реакция, что приведет к увеличению концентрации продуктов реакции СО2 и Н2 и уменьшению концентрации водяного пара, т.е. равновесие смещается вправо. Процесс будет протекать до тех пор, пока не установится новое равновесие.
2) Влияние общего давления в системе.
Если в результате реакции изменяется число молей газообразных веществ, то изменение общего давления в системе вызывает смещение равновесия. Увеличение общего давления вызывает смещение равновесия в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления. Для рассматриваемой реакции увеличение давления должно смещать равновесие влево.
3) Влияние температуры.
С увеличением температуры равновесие смещается в сторону эндотермической реакции, т.е. реакции, протекание которой обеспечивает поглощение теплоты, с уменьшением температуры – в сторону экзотермической реакции.
Химическое равновесие в гетерогенной системе. Константа гетерогенного химического равновесия равна отношению произведения равновесных концентраций или парциальных давлений продуктов реакций к произведению равновесных концентраций или парциальных давлений исходных веществ в степенях, равных их стехиометрическим коэффициентам.
В уравнения констант гетерогенного химического равновесия не входят члены, относящиеся к твердым веществам, участвующим в прямой и обратной реакциях.
Так как прямая и обратная реакции протекают на одной и той же поверхности раздела фаз, то площадь поверхности раздела фаз также не входит в уравнение константы химического равновесия.
Например, для реакции:
С(к) + 2Н2О 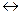 СО2 + 2Н2 Кр=
СО2 + 2Н2 Кр= 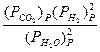 ,
,
а для реакции
СаСО3(к) 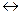 СаО(к) + СО2 Кр=(РСО
СаО(к) + СО2 Кр=(РСО  )р
)р
Константа гетерогенного химического равновесия зависит от температуры. Она возрастает с увеличением температуры в случае эндотермической прямой реакции и уменьшается с увеличением температуры в случае экзотермической прямой реакции. Рассчитать ее можно по уравнению:
Кр=еxp[- 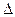 G0/RT]
G0/RT]
Гетерогенное химическое равновесие подчиняется принципу Ле Шателье.
Экспериментальная часть
Опыт 1. Влияние концентрации реагирующих веществ на химическое равновесие.
К одному мл 0,01 М раствора хлорида железа (III) прибавить 1 мл 0,02 М раствора роданида аммония.
Получится раствор с характерной красной окраской, обусловленный присутствием мало диссоциированных молекул Fe(SCN)3. Разлить полученный красный раствор поровну в четыре пробирки. Первую пробирку оставить для сравнения, во вторую добавить несколько капель насыщенного раствора хлорида железа (III), в третью – несколько капель роданида аммония. Перемешать растворы в пробирках. В четвертую пробирку прибавить сухую соль хлорида аммония и энергично перемешать стеклянной палочкой. В каких случаях окраска раствора усиливается, а в каких ослабевает? Объяснить изменение окраски растворов во второй, третьей и четвертой пробирках, пользуясь правилом смещения химического равновесия. Записать уравнение обратимой химической реакции образования Fe(SCN)3 и константу равновесия для нее.
Опыт 2. Изучение равновесия в растворе ионов хромат – дихромат.
Соли хромовой кислоты – хроматы – окрашены в желтый цвет (цвет иона CrO42-), соли двухромовой кислоты – дихроматы – окрашены в оранжевый цвет (цвет иона Cr2O72-). Запишите равновесие, которое может установиться при изменении кислотности среды, учитывая, что в кислой среде существует дихромат ион, а в щелочной – хромат.
В пробирку поместите 1 мл раствора дихромата и прибавьте 5 капель 2н раствора гидроксида натрия. Что наблюдаете? Затем к этому же раствору по каплям прибавляйте 2н раствор фосфорной кислоты до тех пор, пока окраска не станет опять оранжевой. Объясните изменение окраски раствора.
Контрольные вопросы
1) Каковы термодинамические условия химического равновесия?
2) Как рассчитывается константа химического равновесия для: а) гомогенных б) гетерогенных реакций?
3) Какие параметры влияют на смещение химического равновесия?
4) Напишите выражение для константы равновесия гомогенной системы СН4 + СО2 ↔ 2СО + 2Н2. Как следует изменить температуру и давление, чтобы повысить выход водорода? Прямая реакция – образование водорода - эндотермическая.
5) Вычислите константу равновесия для гомогенной системы
СО (г) + Н2О (г) ↔ СО2 + Н2 (г), если равновесные концентрации реагирующих
веществ: [СО] = 0,004 моль/л; [Н2О] = 0,064 моль/л; [СО2] = 0,016 моль/л; [Н2] = 0,016 моль/л.
6) Исходные концентрации NO и Cl2 в гомогенной системе
2NO + Cl2 ↔ 2NOCl
составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO.
7) Напишите выражение для константы равновесия гетерогенной системы:
СО2 + С ↔ 2СО. Как следует изменить давление, чтобы повысить выход СО?
7 ЛАБОРАТОРНАЯ РАБОТА № 7. ПРИГОТОВЛЕНИЕ РАСТВОРОВ
Цель: На практике изучить способы приготовления растворов различной концентрации.
Теоретическая часть
Раствором называется твердая или жидкая гомогенная система, состоящая из 2-х или более компонентов и продуктов их взаимодействия, относительные количества которых могут изменяться в довольно широких пределах.
Раствор состоит из растворителя и одного или несколько растворенных веществ. Количественной характеристикой раствора является концентрация. Концентрацией раствора называется количество растворенного вещества в единице веса или объёма. Концентрации бывают:
а) Массовая доля растворенного вещества (весовые проценты) – масса растворенного вещества в 100 г. раствора. Например, 15%-ный раствор соды содержит 15 г. соды и 85 г. воды. Определяется по формуле:
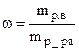 или
или 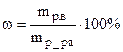
где mр.в – масса растворенного вещества, mр-ра – масса раствора.
б) Молярная (СМ) – количество моль растворенного вещества в 1 литре (дм3) раствора. Например, 2М раствор NаОН содержит в 1 литре раствора 80 г. (2 моль) щелочи. Определяется по формуле:
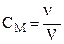
где ν – количество моль растворенного вещества, V – объем раствора в литрах.
в) Молярная концентрация эквивалентов (Сэк.; N) – количество эквивалентов вещества (моль) в 1 литре раствора. Например, 2н раствор серной кислоты содержит 2 моль эквивалентов серной кислоты в 1 литре раствора. Определяется по формуле:

где νэк. – количество моль эквивалентов растворенного вещества, V – объем раствора в литрах. Количество эквивалентов равно отношению массы растворенного вещества к молярной массе эквивалентов этого же вещества.
Молярная масса эквивалентов кислоты равна её молярной массе, деленной на число ионов водорода, входящих в состав кислоты:
Мэк. (Н2SО4) = М/2 = 98/2 = 49 г/моль
Молярная масса эквивалентов основания равна его молярной массе, деленной на число гидроксильных групп в основании:
Мэк.(Ва(ОН)2 ) = М/2 = 171/2 = 85,5 г/моль.
Молярная масса эквивалентов соли равна ее молярной массе, деленной на произведение количества ионов металла и его валентности:
Мэк.(Аl2(SO4)3) = М/ n.В = 342/2.3 = 57 г/моль.
Например, 0,1н раствор Н2SО4 содержит 0,1 моль эквивалентов (4,9 г.) кислоты в 1 литре (дм3) раствора.
г) Моляльная (Сm) – количество моль растворенного вещества в 1000 граммов растворителя. Определяется по формуле:

д) Титр (Т) – количество граммов растворенного вещества в 1 миллилитре (см3) раствора (г/мл).
Если в 25 мл (см3) раствора содержится 5 г. NaCl, то его титр равен: Т = 5/25 = 0,2 г/мл
При переходе от весовой (%-ной) концентрации к объемным (молярной или нормальной) концентрациям необходимо учитывать плотность раствора: ρ– массу одного мл (см3) раствора;
ρ = m/V (г/см3)
Экспериментальная часть
Опыт 1. Приготовление раствора заданной концентрации из навески твердого вещества.
Получите у преподавателя задание на приготовление определенного количества и определенной %-ной концентрации раствора. Рассчитайте количество вещества и количество воды, необходимые для приготовления раствора. Возьмите навеску соли на технических (квадрантных) весах, поместите ее в стакан. Отмерьте цилиндром рассчитанное количество воды и перелейте ее в стакан с навеской. Растворите навеску и измерьте плотность полученного раствора ареометром в мерном цилиндре на 50 мл. Рассчитайте молярную, нормальную концентрации и титр приготовленного раствора.
Опыт 2. Приготовление раствора разбавлением более концентрированного раствора.
Получите у преподавателя задание на приготовление раствора заданной нормальности. По известной концентрации исходного раствора рассчитайте необходимое его количество для приготовления вашего раствора, используя закон эквивалентов: (V1. N1 = V2.N2, где V – объем раствора в мл, N – молярная концентрация эквивалентов). Отмерьте бюреткой необходимое количество исходного раствора, поместите его в мерную колбу, долейте на 2/3 объёма дистиллированной водой и размешайте. После этого долейте воду до метки на мерной колбе. Приготовленный раствор сдайте преподавателю. В приготовленном вами растворе определите молярную и процентную концентрацию, приняв плотность раствора за единицу.
Контрольные вопросы
1) Что такое раствор?
2) Что является количественной характеристикой раствора?
3) Какие способы выражения концентраций растворов вы знаете?
4) Как готовится раствор по точной навеске?
5) Как готовится раствор разбавлением?
6) Рассчитайте молярную концентрацию 10% раствора сульфата натрия. Какова будет молярная концентрация эквивалентов этого раствора?
7) Молярная концентрация раствора сульфата меди (+2) равна 1М. Чему равна массовая доля растворенного вещества? титр данного раствора?
8) Чему равен объем 2М раствора серной кислоты, необходимый для приготовления 100 мл 0,1М раствора серной кислоты?
Дата добавления: 2015-01-21; просмотров: 2717;
