Классификация анионов
Классификация анионов основывается в большинстве случаев на различной растворимости солей бария и серебра соответствующих кислот.
Анионы в основном не мешают обнаружению друг друга, поэтому часто обнаружение анионов ведут дробным методом, т.е. в отдельных порциях исследуемого раствора. При анализе анионов групповые реагенты (BaCl2, AgNO3) используют не для разделения анионов на группы, а для установления их наличия или отсутствия. Со многими реакциями анионов мы встречались при изучении катионов. Например, ионы бария и свинца можно обнаружить с помощью анионов SO42ˉ и CrO42ˉ соответственно. Другими словами, многие катионы и анионы взаимно открывают друг друга.
Опыт 7 Качественные реакции на отдельные анионы
Реакции SO42ˉ- ионов
SO42ˉ– анион сильной кислоты. Из соли серной кислоты нерастворимы соли ионов Ba2+, Sr2+, Ca2+,Pb2+ остальные сульфаты хорошо растворимы. Ион SO42ˉ бесцветен. К раствору серной кислоты или ее соли добавьте хлорид бария наблюдайте выпадение осадка белого цвета, нерастворимого в кислотах. Составьте уравнение реакции в молекулярном и ионном виде,
Реакции СO32ˉ- ионов
Карбонат-ион СO32ˉ – анион слабой угольной кислоты, неизвестной в свободном состоянии. При получении ее из солей она почти полностью распадается на CO2 и H2O. Кислоты разлагают карбонаты с выделением углекислого газа.
В пробирку поместите 1мл исследуемого раствора, прилейте раствор 2н соляной кислоты. Наблюдайте выделение углекислого газа.
Реакции NO3ˉ- ионов
Азотная кислота в кислой среде окисляет дифениламин, что сопровождается появлением интенсивной синей окраски.
На тщательно вымытое и вытертое досуха часовое стекло поместите 2-3 капли дифениламина (приготовлен на концентрированной серной кислоте! Будьте осторожны при работе с этим реактивом!). Если наблюдается посинение раствора, значит, стекло недостаточно чистое. Внесите туда же одну каплю исследуемого раствора. При наличии нитрат - иона появляется интенсивная синяя окраска.
Реакции Clˉ- ионов
Реакция с нитратом серебра. К 1 капле исследуемого раствора добавьте 1-2 капли раствора AgNО3. В присутствии Cl-иона выпадает белый творожистый осадок AgCl. Составьте уравнение реакции в молекулярном и ионном виде.
На свету осадок темнеет. Чтобы убедиться, что это хлорид серебра, слейте с осадка жидкость и добавьте к осадку раствор аммиака. При этом AgCl растворяется, образуя комплексный ион. Составьте уравнение реакции в молекулярном и ионном виде.
Контрольные вопросы
1) Какой реактив является групповым на вторую аналитическую группу по кислотно-щелочному методу качественного анализа?
2) На какую аналитическую группу по кислотно-щелочному методу раствор гидроксида натрия, взятый в избытке, является групповым реагентом?
3) Катионы какой аналитической группы по кислотно-щелочному методу качественного анализа растворяются в водном растворе аммиака с образованием аммиакатов?
4) При действии на исследуемый раствор соляной кислотой выпадает белый творожистый осадок, растворимый в избытке раствора аммиака. Какой ион так можно определить?
5) При действии на исследуемый раствор по каплям раствора гидроксида натрия выпадает белый осадок, растворимый в избытке раствора аммиака. Какой ион так можно определить?
17 ЛАБОРАТОРНАЯ РАБОТА № 17. ТИТРОВАНИЕ ПО МЕТОДУ НЕЙТРАЛИЗАЦИИ
Цель: Изучить основные операции объемного анализа — приготовление растворов, освоить методику титрования, определить концентрацию раствора щелочи.
Теоретическая часть
Сущность метода нейтрализации
К методу нейтрализации относятся все количественные объемные определения, в основе которых лежит реакция нейтрализации:
Н+ + ОН¯ = Н2О
По этому методу можно, пользуясь титрованным раствором какой-либо кислоты, проводить количественное определение щелочи или, пользуясь титрованным раствором щелочи, количественно определять кислоту. С помощью этого метода проводят ряд других объемных определений, так или иначе связанных с реакцией нейтрализации, например определение некоторых солей, имеющих вследствие гидролиза сильнощелочную реакцию и потому титрующихся кислотами, определение жесткости воды и т.д.
Основными рабочими растворами метода нейтрализации являются раствор кислоты (обычно HCl или HNO3) и раствор щелочи (обычно КОН или NaОН).
Эти вещества не отвечают требованиям, которые предъявляются к исходным веществам, и потому титрованные растворы нельзя приготовить исходя из точной навески вещества. Титр приготовленных растворов устанавливают путем титрования (или весовым путем). В качестве исходных веществ, при установке титров кислот чаще всего применяют тетраборат натрия (буру) Na2B4O7х10H2O, или карбонат натрия (соду) Nа2СО3. Перекристаллизацией эти вещества могут быть получены практически свободными от примесей, строго отвечающими своим формулам. Растворы их обладают сильнощелочной реакцией и могут титроваться кислотами. Как известно, реакция нейтрализации не сопровождается видимыми изменениями, поэтому для фиксирования точки эквивалентности прибавляют к титруемому раствору какой-либо подходящий индикатор. В качестве индикаторов метода нейтрализации служат вещества, окраска которых меняется в зависимости от изменения величины рН. К ним относятся лакмус, метилоранж, фенолфталеин.
Экспериментальная часть
Титрование
Для титрования пользуются бюретками. Бюретка – цилиндрическая трубка с делениями, с суженным концом, к которому при помощи резиновой трубки присоединяют оттянутую стеклянную трубочку. На свободную часть резиновой трубки надевают металлический зажим. Бюретку тщательно вымойте дистиллированной водой, после чего ополосните 2 раза небольшим количеством стандартного раствора HNO3, чтобы удалить из нее остаток воды, затем заполните бюретку 0,1н раствором HNO3. Подставив под носик бюретки стаканчик, и открыв зажим, заполните носик бюретки так, чтобы в нем не осталось пузырьков воздуха. Получите у преподавателя образец раствора щелочи в мерной колбе на 100 мл. Доведите объем раствора дистиллированной водой до метки. Закройте пробкой и перемешайте полученный раствор, переворачивая колбу. В коническую колбу поместите пипеткой 10 мл полученного раствора щелочи. Предварительно необходимо дважды ополоснуть пипетку этим же раствором щелочи. Пользуясь пипеткой, соблюдайте правило: последнюю оставшуюся каплю не выдувайте, а снимите прикосновением кончика пипетки к стенке колбы. Отмерив 10 мл раствора щелочи в коническую колбу, прибавьте к нему 2-3 капли метилоранжа. В другой такой же колбе приготовьте раствор – «свидетель». Для этого отмерьте 10 мл дистиллированной воды, добавьте 2-3 капли метилоранжа и 1 каплю раствора кислоты из бюретки так, чтобы появилось слабое порозовение раствора. После этого установите уровень раствора кислоты в бюретке на нуле. Поставьте колбу с раствором щелочи под носик бюретки на лист белой бумаги и рядом колбу со свидетелем и по каплям приливайте из бюретки раствор кислоты, постоянно перемешивая раствор в колбе плавными круговыми движениями. Необходимо уловить момент, когда от одной капли HNO3 первоначально желтый раствор щелочи приобретет такой же розовый оттенок, как у приготовленного свидетеля. Отметьте, какое количество кислоты пошло на титрование щелочи, и запишите результат. При снятии отсчета необходимо, чтобы глаз был на уровне мениска бюретки. Точное титрование надо повторить три раза, а при необходимости и больше раз, если будут расхождения в данных. Разница в параллельных опытах не должна превышать 0,2 мл. Полученные и рассчитанные данные запишите в таблицу.
Вычисления:
Из полученных данных вычислите среднее значение объема раствора HNO3, пошедшее на титрование щелочи.
Молярная концентрация эквивалентов щелочи определяется по закону эквивалентов:
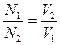 ; или N1V1 = N2V2 (1)
; или N1V1 = N2V2 (1)
Nщелочи = 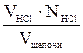 (2)
(2)
Результат запишите с точностью до четвертого знака после запятой. Рассчитайте титр приготовленного раствора щелочи, результат запишите с точностью до шестого знака после запятой.
Таблица 8 - Результаты титрования по методу нейтрализации
| № п/п | Vщелочи, мл | Vкислоты, мл | Vср.щелочи мл | Скислоты, моль/л | Сщелочи, мл | Тщелочи, г/мл |
Контрольные вопросы:
1) В чем сущность метода нейтрализации? Что можно определить этим методом?
2) Какие растворы называются титрованными?
3) Как фиксируется точка эквивалентности в методе нейтрализации?
4) Какие вещества используются в качестве исходных для установления титра рабочего раствора HNO3?
5) Титрование – что это за операция?
6) Как рассчитывается молярная концентрация эквивалентов и титр раствора щелочи?
18 ЛАБОРАТОРНАЯ РАБОТА № 18. ОПРЕДЕЛЕНИЕ ЖЕСТКОСТИ ВОДЫ
Цель: Познакомиться со свойствами растворимых и нерастворимых соединений кальция и магния, обуславливающих жесткость воды. Научиться определять жесткость воды методом титрования.
Теоретическая часть
Человечество широко использует для своих целей воду.
Общие запасы воды на Земле огромны, они составляют примерно 1/800 часть объема нашей планеты. Однако основная часть воды приходится на Мировой океан. Так как человечество в основном использует пресную воду, то доля используемой воды относительно невелика.
В природе идет непрерывный круговорот воды. Природная вода находится во взаимодействии с окружающей средой. Она реагирует с атмосферой, почвой, растительностью, минералами и различными породами. При этом вода растворяет органические и неорганические соединения. Все примеси природных вод можно подразделить на три группы в зависимости от размера частиц: истинно растворенные, коллоидные и взвешенные. По химическому составу примеси подразделяются на органические и неорганические. Органические примеси имеют очень сложный состав и находятся в коллоидном или истинно растворенном состоянии. Неорганические примеси находятся в виде ионов: К+, Са2+, Сlــ, НСО3−  и др. В воде растворены кислород, азот, СО2 и другие газы.
и др. В воде растворены кислород, азот, СО2 и другие газы.
Состав природных вод принято характеризовать некоторыми технологическими показателями, в том числе жёсткостью, щелочностью и солесодержанием.
Жесткость воды отражает содержание в ней ионов кальция и магия:
Ж = [Са2+] + [Мg2+]
Природная вода, содержащая в 1 литре большое количество растворимых солей кальция и магния, называется жесткой. Суммарное содержание этих солей в воде называется её общей жесткостью. Она выражается суммой миллиграмм-эквивалентов ионов кальция и магния, содержащихся в 1 л. воды. 1 мг/экв. жесткости равен 20,04 мг/л Са2+ или 12,16 мг/л Мg2+. Различают карбонатную и некарбонатную жесткость воды. Карбонатнойназывают жесткость, обусловленную присутствием в воде гидрокарбонатов кальция Са(НСО3)2 и магния Мg(НСО3)2. Некарбонатная жёсткость обусловлена наличием солей сильных кислот – сульфатов или хлоридов кальция и магния. Некарбонатная жесткость представляет собой разность между общей и карбонатной жесткостью. Карбонатная жесткость, удаляющаяся при длительном кипячении воды, называется временной жесткостью. Некарбонатная жесткость называется постоянной жесткостью.
Определение жёсткости имеет очень большое практическое значение. При питании паровых котлов жесткой водой их стенки постепенно покрываются накипью. Осадок СаСО3 и МgСО3 легко отделяется от стенок котла. Хуже отделяется слой гипсовой накипи СaSО4. Теплопроводность накипи очень мала, поэтому расход топлива увеличивается. Для смягчения воды, питающей паровые котлы, необходимо знать карбонатную и некарбонатную жесткость. Жесткая вода усиливает коррозию металлов и бетона. От количества растворенных в воде солей кальция и магния сильно зависят вкусовые качества питьевой воды. Поэтому необходимо знать способы умягчения воды и химию этих процессов.
Для малорастворимых солей при постоянной температуре соблюдается постоянство произведений активностей ионов, называемое произведением растворимости ПР. Например при 20оС для равновесий:
СаСО3 ↔ Са2+ + СО32ˉ;
Мg(ОН)2 ↔ Мg2+ + ОНˉ
ПР СаСО 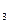 = а(Са2+) ∙ а(СО32ˉ) = 10−8,
= а(Са2+) ∙ а(СО32ˉ) = 10−8,
ПРMg(ОН) 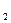 = а(Мg2+) ∙ а2 (ОН− )= 1,2 ∙ 10−11
= а(Мg2+) ∙ а2 (ОН− )= 1,2 ∙ 10−11
Концентрацию иона, входящего в малорастворимое соединение, можно уменьшить увеличением концентрации иона противоположного знака, входящего в то же соединение. Например, концентрацию ионов Са2+ и Мg2+ можно понизить увеличением концентрации ионов СО32ˉ и ОНˉ соответственно. Этот принцип можно использовать для осаждения примесей из растворов. Метод осаждения малорастворимых соединений применяется для очистки воды, например, для ёе умягчения (снижения жесткости). Для уменьшения карбонатной жесткости применяется метод известкования, при котором в обрабатываемую воду вводят известь Са(ОН)2.
Экспериментальная часть
Опыт 1. Определение карбонатной жесткости воды (временной).
Для определения карбонатной жесткости воды определенный объем воды титруют рабочим раствором азотной кислоты в присутствии индикатора метилового оранжевого. При этом протекают реакции:
Са(НСО3)2 +2 HNO3 = Са(NO3)2 + 2СО2 +2Н2О
Мg(НСО3)2. +2 HNO3l = Мg(NO3)2 + 2СО2 +2Н2О
Способ основан на предположении, что вода не содержит кислых углекислых солей других металлов, например NаНСО3.
Для определения отмерьте мерным цилиндром в 2 конические колбы по 50 мл водопроводной воды и добавьте к ней 2-3 капли метилоранжа. Одна из колб будет контрольной для сравнения окраски индикатора. Во вторую колбу приливайте из бюретки, при постоянном перемешивании, по каплям 0,1н раствор НСl до перехода окраски индикатора из желтого цвета в оранжевый. Цвет окраски индикатора сравните с окраской раствора в контрольной колбе. Титрование повторите три раза и для расчета жесткости возьмите средний результат.
Расчет карбонатной жесткости проводится по формуле:
ЖВ = 
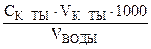 ммоль/л, где
ммоль/л, где
ЖВ – временная жесткость воды в ммоль/л,
СК-ТЫ – молярная концентрация эквивалентов концентрация HNO3 в ммоль/л,
VК-ТЫ – объем кислоты, затраченный на титрование 50 мл воды,
VВОДЫ – объем воды в мл.
Опыт 2. Определение общей жесткости воды.
Общую жесткость воды удобно определять комплексонометрическим методом. Сущность его заключается в способности двузамещенной соли этилендиаминтетрауксусной кислоты (комплексон – Б, трилон - Б) образовывать с солями кальция и магния малодиссоциированные комплексные соединения. Из комплексона – Б (трилона - Б) готовят титрованный раствор с помощью индикатора эриохрома черного. В эквивалентной точке при титровании он изменяет винно-красную окраску на синюю. Титрование проводится при рН = 9, добавляя аммиачный буферный раствор.
Отмерьте мерным цилиндром в коническую колбу 50 мл водопроводной воды, добавьте 5 мл буферного раствора, 1 шпатель индикатора эриохрома черного, при этом раствор окрасится в винно-красный цвет. Приготовленный раствор титруйте из бюретки 0,05н раствором трилона - Б до изменения окраски в синий цвет.
ЖО = 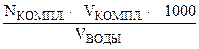
где Nкомпл. — молярная концентрация эквивалентов трилона – Б в ммоль/л
Vкомпл. — объем трилона – Б, в мл
Vводы — объём воды, в мл.
Зная общую и временную жесткость, вычислите постоянную жесткость данной пробы воды.
Контрольные вопросы
1)Чем обуславливается жесткость воды?
2) Назовите виды жесткости воды.
3) Какие Вы знаете способы умягчения воды?
4) В каких единицах выражается жесткость воды?
5) Как можно определить карбонатную и общую жесткости воды?
19 ЛАБОРАТОРНАЯ РАБОТА №19.Свойства полимерных материалов
Цель:На конкретных примерах изучить физические и химические свойства полимерных материалов.
Теоретическая часть
Термин «полимер» охватывает все вещества, молекулы которых построены из множества элементов или звеньев. Эти элементы включают в себя как отдельные атомы, так и небольшие группы атомов, соединённые химическими связями. Для большинства полимеров повторяющимся элементом структуры является небольшая группа атомов, соединённых определённым образом.
Характерной чертой полимера является то, что молекула полимера представляет собой молекулу его низкомолекулярного аналога, соединённую с другими такими же молекулами п раз химическими связями, где п – степень полимеризации – может быть очень большой величиной (десятки и сотни тысяч).
Соединение большого числа одинаковых или разных низкомолекулярных молекул в процессе химической реакции приводит к появлению у полимера целого комплекса новых физико-механических свойств – высокой упругости, эластичности, способности к плёнко- и волокнообразованию. Важным свойством полимера является их устойчивость к нагреванию. Полимеры, способные при нагревании размягчаться, изменять форму и при охлаждении ее сохранять, относятся к термопластичным. Полимеры, не способные размягчаться и изменять свою форму относятся к термореактивным.
При одинаковом химическом строении низкомолекулярных соединений и полимеров последние обладают рядом особенностей:
- полимер может существовать только в конденсированном твёрдом или жидком состоянии; переход в газообразное состояние невозможен без разрыва молекулы;
- растворы полимеров (даже разбавленные) имеют очень высокую вязкость;
- скорость растворения существенно меньше и растворению обычно предшествует набухание;
- для некоторых полимеров характерны большие обратимые деформации;
- химические реакции полимеров отличаются от аналогичных реакций низкомолекулярных веществ скоростью и протеканием большого числа побочных реакций; свойства полимеров резко изменяются при действии очень небольших количеств реагента.
Полимеры можно получить по реакциям полимеризации и поликонденсации.
Экспериментальная часть
Работа выполняется в группах. По указанию преподавателя каждая группа анализирует три образца, а затем группы обмениваются результатами анализа, которые заносят в таблицу, делают выводы о механических и химических свойствах полимеров.
Опыт № 1. Отношение пластмасс к растворителям.
Поместите в 3 пробирки по кусочку разного вида полимеров. В каждую пробирку прилейте по 1 -2 мл диметилформамида и выдержите 30 мин. По истечению указанного времени проверьте состояние образцов и сделайте вывод о растворимости каучука и пластмасс.
Опыт № 2. Отношение полимеров к нагреванию и горению.
В фарфоровую чашку поместите поочерёдно по кусочку образцов полимеров и нагрейте на электроплитке. Через несколько минут образцы проверьте, прикасаясь к ним стеклянной палочкой. Отметьте скорость размягчения образцов и характер этого размягчения в зависимости от степени нагревания. Кусочки этих же пластмасс закрепите в проволоке (продетой через корковую пробку, чтобы было удобно держать в руке) и внесите в пламя спиртовки. Отметьте характер горения.
Опыт № 3. Отношение полимеров к растворам щелочей, кислот.
В три пробирки поместите поочерёдно по кусочку образцов полимеров и прилейте 1 – 2 мл концентрированной азотной кислоты. Содержимое пробирок осторожно встряхивайте. Через несколько минут слейте кислоту, промойте полимер водой и определите стойкость её к действию кислоты.
Опыт повторите с теми же образцами пластмасс с 20%-ным раствором гидроксида натрия.
Все результаты заносите в таблицу.
Таблица 9 - Результаты опыта изучения свойств полимеров
| Полимер | Формула струк-турного звена | Внешние признаки | Отношение к нагрева-нию | Действие | ||
| Диметилформамида | HNO3 конц. | NaOH (20%-й р-р) | ||||
| полиэтилен | ||||||
| капрон | ||||||
| силикон | ||||||
| фторопласт | ||||||
| поливинилхлорид | ||||||
| полиметилметакрилат | ||||||
| Фенопласт (фенолформальдегидная смола) | ||||||
| лавсан | ||||||
| полистирол |
Сделайте вывод.
Контрольные вопросы:
1) Что такое полимер?
2) Способы получения полимеров. В чем их принципиальное различие?
3) Отличительные особенности полимеров от низкомолекулярных соединений.
4) Отличие термопластов от реактопластов.
5) Какие полимеры не используется в качестве изоляционных материалов в электротехнике?
6) Каково строение органических веществ, обладающих полупроводниковыми свойствами?
7) Как связаны механические свойства полимеров с их структурой?
СПИСОК ЛИТЕРАТУРЫ
1. Глинка Н.Л. Общая химия: Учебное пособие /Под ред А.И.Ермакова - М.: Интеграл-Пресс, 2002. – 728 с.
2. Коровин Н.В. Общая химия: учебник для технических напр. и спец. вузов -М.: Высшая школа, 2000. – 558 с.
3. Глинка Н.Л. Задачи и упражнения по общей химии. /Под ред. Рабиновича В.А. и Рубинной Х.М. – Л.: Химия, 1986. -272 с.
4. Хомченко Г.П. Практикум по общей и неорганической химии с применением полумикрометода: Учеб. пособие для вузов. -2-е изд., перераб. и доп. – М.: Высш. школа, 1980. – 333 с.
5 Фролов В.В. Химия М.: Высшая школа, 1986. – 543 с.
6 Ахметов Н.С. Общая и неорганическая химия. - М.: Высшая школа, 2002. – 743с.
7 Общая химия: Учебник /Под ред. Е.М.Соколовской и Л.С.Гузея – М.: изд. МГУ, 1998. – 640 с.
Приложение А
(обязательное)
Форма оформления титульного листа
Министерство образования и науки
Республики Казахстан
Рудненский индустриальный институт
Кафедра безопасности жизнедеятельности промышленной экологии
Отчет по лабораторной работе №
Тема:
Дисциплина «Химия»
Преподаватель:
доцент, к.х.н.
___________ И.В. Барулина
(подпись)
«____» _____________ 20___ г.
Студент:
____________ Б.С. Ахметов
(подпись)
Группа:
№ зачетной книжки ___________
«____» ______________ 20 ___г.
Рудный 20__
Приложение Б
(обязательное)
Форма оформления лабораторной работы
Цель работы:
| № опыта, его название и краткое содержание | Наблюдение к опыту | Уравнения реакций (молекулярные и ионные) | Вывод по опыту | Примечание |
Выводы по работе:
Приложение В
(обязательное)
Пример оформления работы по качественному анализу
Специфичные качественные реакции катионов и анионов
| № | Определяемый ион | Добавляемый реагент | Наблюдаемый внешний эффект реакции | Уравнение реакции | Вывод |
| К+ | H6C4O6 CH3COONa | Выделяется белый осадок, после трения стенок пробирки ст. палочкой. | К++ НС4Н4О6¯ →К НС4Н4О6↓ | Качест- венная реакция на ион К+ |
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РЕСПУБЛИКИ КАЗАХСТАН
Рудненский индустриальный институт
РассмотренО
на заседании кафедры БЖиПЭ
Протокол № от
Заведующий кафедрой Куликова Г.Г.
Дата добавления: 2015-01-21; просмотров: 1360;
