ЛАБОРАТОРНАЯ РАБОТА № 3. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Цель: Изучить строение свойства комплексных соединений и сделать вывод о возможности реального существования этих соединений.
Теоретическая часть
Комплексные соединения относятся к группе сложных веществ, в которых атомы и группы атомов соединяются посредством валентной и координационной связи, например, в соединении [Cu(NH3)4]SO4 молекулы NH3 связываются посредством координационной связи, а комплексный ион с анионом SО42- за счет ионной связи. В водных растворах они распадаются не на те ионы, из которых состояли соли, а образуют при диссоциации новые более сложные комплексные ионы:
[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42-
K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-
Согласно теории Вернера, в молекуле каждого комплексного соединения центральное место занимает атом или ион с характерным для него зарядом. Центральный атом или ион носит название комплексообразователя. С ним связаны находящиеся в непосредственной близости ионы или нейтральные группы атомов, называемые лигандами (адденды). Комплексообразователь вместе с лигандами образует при диссоциации комплексный ион. Количество лигандов, связанных с комплексообразователем, называется координационным числом. Ионы, не вошедшие во внутреннюю сферу, располагаются на более далеком расстоянии от комплексообразователя и образуют внешнюю сферу. Заряд комплексного иона определяется алгебраической суммой зарядов комплексообразователя и тех ионов или нейтральных групп, которые находятся во внутренней сфере.
Например, в комплексном соединении: К3 [Fe (CN)6 ]
Fe3+ – комплексообразователь,
CNˉ - лиганды,
3К+ - внешняя сфера,
6 - координационное число.
[ Fe(CN)6]3ˉ - комплексный ион (внутренняя сфера) 
Различные комплексные ионы обладают различной устойчивостью. Комплексные ионы, обладающие высокой устойчивостью, далее не распадаются на ионы. Так, например, [PtCl4]2ˉ. Комплексные ионы, обладающие меньшей устойчивостью в растворе, частично диссоциируют. Согласно закону действия масс можно записать константу, которая носит название константы нестойкости комплекса: 


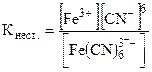
К комплексным соединениям, обладающим малой устойчивостью комплексного иона, относятся двойные соли, которые диссоциируют с образованием всех тех ионов, которые находились в растворах простых солей, например:
KAl(SO4)2  = K+ + Al3+ + 2SO42-
= K+ + Al3+ + 2SO42-
Экспериментальная часть
Опыт 1. Получение и исследование комплексного соединения сульфата тетраамминмеди (+2)
Налейте в две пробирки по 2 мл раствора сульфата меди и добавьте в одну несколько капель хлорида бария, а во вторую – внесите кусочек гранулированного олова. На присутствие каких ионов указывают данные реакции? Напишите уравнения реакций. Затем в пробирку налейте 2 мл сульфата меди и по каплям добавляйте 25% раствор аммиака (NH4OH). Наблюдайте растворение выпавшего вначале осадка основного сульфата меди (CuOH)2SO4 и изменение цвета раствора при образовании комплексного соединения сульфата тетраамминмеди (+2). Полученный раствор разделите на две пробирки и проделайте те же опыты, которые были проделаны с раствором медного купороса. Выпадает ли осадок при добавлении хлорида бария? Выпадает ли медь на грануле олова? Напишите уравнения всех проделанных реакций. Есть ли различия в поведении сульфата меди и комплексной соли по отношению к каждому добавленному реактиву? Комплексное соединение диссоциирует на 2 иона. Напишите его координационную формулу и уравнение электролитической диссоциации.
Опыт 2. Анионные комплексы
В две пробирки поместите раздельно растворы солей цинка и хрома (+3) и в каждую из них добавляйте по каплям раствор щелочи. Наблюдайте в каждой пробирке вначале выпадение осадка, а затем его растворение в избытке щелочи. Напишите уравнения проделанных реакций, учитывая, что образуются растворимые гидроксокомплексы, содержащие ионы: 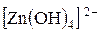 ,
, 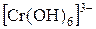 . Зная, что гидроксиды цинка и хрома растворяются также в кислотах, указать к какому типу оснований они относятся.
. Зная, что гидроксиды цинка и хрома растворяются также в кислотах, указать к какому типу оснований они относятся.
Опыт 3. Катионные комплексы. Получение и разрушение диаммина серебра
Добавьте в пробирку с несколькими каплями азотнокислого серебра раствор хлорида натрия. К образовавшемуся осадку добавьте 25% раствор аммиака. Происходит образование растворимой комплексной соли серебра 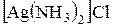 . Составьте уравнения реакций образования осадка и его растворения. Полученный раствор сохраните для следующего опыта.
. Составьте уравнения реакций образования осадка и его растворения. Полученный раствор сохраните для следующего опыта.
Разрушение диаммина серебра.
К раствору хлорида диамминсеребра, оставшегося от предыдущего опыта прибавьте азотную кислоту до кислой реакции (проверьте лакмусовой бумажкой). Выпадает белый осадок хлорида серебра. Составьте уравнение электролитической диссоциации комплексного иона и объясните роль кислоты.
Контрольные вопросы
1) Какие соединения называются комплексными?
2) Какова структура комплексных соединений?
3) Какие частицы могут выступать в качестве лигандов?
4) Как называются комплексные соединения катионного и анионного типа?
5) Что такое константа устойчивости и константа нестойкости комплексного иона? Как они связаны между собой?
6) В состав комплексного соединения входят: Co3+, 5NH3, 3Cl¯. На взаимодействие 1 моль комплексного соединения требуется 2 моль нитрата серебра. Составьте комплексной соединение, назовите его и все составные части.
7) Напишите уравнение реакции образования комплексного соединения, которое образуется при взаимодействии хлорида алюминия (III) с избытком гидроксида натрия
Дата добавления: 2015-01-21; просмотров: 4928;
