Механизмы гликогенолиза и липолиза
Гормональная регуляция межуточного обмена и продукции энергии является одной из наиболее изученных областей действия пептидных гормонов. Общие аспекты гормональной регуляции гомеостаза глюкозы выяснены сравнительно полно, но клеточные механизмы оказались более сложными, чем считали ранее. В периоды голодания основным источником глюкозы крови служит печень, высвобождающая сахар со скоростью, зависящей от содержания глюкозы в крови и действия катаболических гормонов, таких, как глюкагон и катехоламины. В физиологических условиях главным ингибитором высвобождения глюкозы является инсулин, причем секретируясь после приема пищи, он противодействует эффектам катаболических гормонов. Глюкоза, высвобождаемая печенью при голодании, вначале продуцируется за счет гликогенолиза, но после истощения запасов гликогена в органе — за счет глюконеогенеза из лактата и аминокислот.
Исследования Rail и Sutherland по гликогенолизу в печени собак показали, что цАМФ, образуемый аденилатциклазой в ответ на действие глюкагона и адреналина, вызывает активацию гликогенфосфорилазы [45]. Эта реакция зависит от превращения фосфорилазы киназы из неактивной (дефосфо-) формы в активный фосфорилированный фермент, который затем катализирует превращение гликогенфосфорилазы b в активную фосфорилазу а в ходе последующего этапа фосфорилирования. Активная фосфорилаза разрушает гликоген до глюкозо-1-фосфата, превращающегося в глюкозо-6-фосфат, а затем в свободную глюкозу, высвобождаемую в кровь (рис. 4—13). цАМФ-зависимый фермент, ответственный за активацию фосфорилазы киназы, названный вначале киназой фосфорилазкиназы, оказался широко распространенным в природе-и способным катализировать фосфорилирование многих белковых субстратов, а не только фосфорилазу киназы. Это привело к мысли о том, что все эффекты цАМФ у высших организмов опосредуются реакциями фосфорилирования белков, осуществляемыми цАМФ-зависимой протеинкиназой, выступающей в роли внутриклеточного рецептора цАМФ [39].
Общая схема метаболизма гликогена в печени, приведенная на рис. 4—13, начинается с активации протеинкиназы катаболическими гормонами, вслед за чем происходит фосфорилирование фосфорилазкиназы и гликогенсинтетазы [46]. Фосфорилирование активирует киназу и инактивирует синтетазу, вызывая ускорение фосфоролитического расщепления гликогена и снижение его синтеза из. УДФ-глюкозы. Протеинкиназа опосредует влияние цАМФ на распад гликогена и в скелетной мышце, обеспечивая ткань глюкозо-1-фосфатом для гликолиза. В печени, помимо стимуляции распада гликогена до глюкозы и угнетения синтеза гликогена, цАМФ стимулирует также глюконеогенез из таких предшественников, как аланин, лактат и пируват.
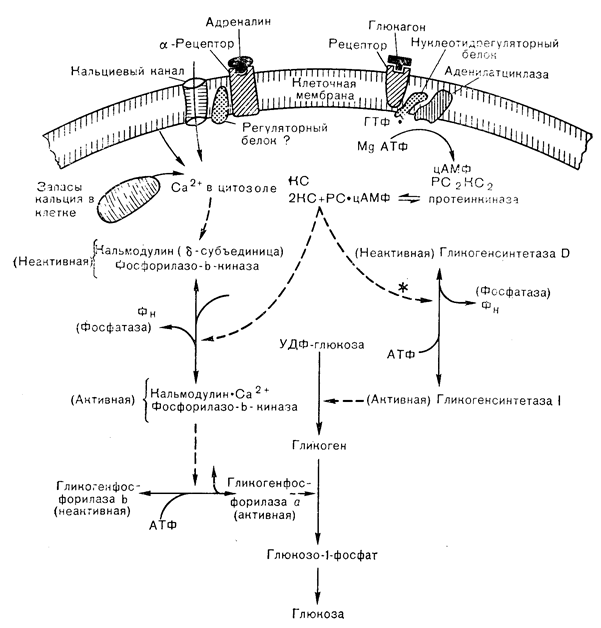
Рис.4—13. Регуляция печеночного гликогенолиза гормонами, действующими через цАМФ-зависимую протеинкиназу и кальцийзависимые процессы. Каталитическая субъединица (КС); отделяющаяся под действием цАМФ от голофермента протеинкиназы, фосфорилирует и активирует гликогенфосфорилазу (через фосфорилазу киназы) и обусловливает фосфорилирование и инактивацию гликогенсинтетазы (вероятно, через тот же фермент), что приводит к распаду гликогена и увеличению продукции глюкозы. Повышение содержания кальция в цитозоле, обусловленное поглощением или мобилизацией кальциевых запасов, действует как фактор, опосредующий влияние a-агонистов (а также вазопрессина и ангиотензина II) на активацию фосфорилазкиназы, путем связывания с кальмодулином — d-субъединицей фосфорилазо-b-киназы. PC — регуляторная субъединица; Фн — фосфор неорганический.
Хотя главным регулятором быстрого высвобождения глюкозы из печени считается глюкагон, но катехоламины также, по-видимому, играют важную роль в этом процессе у некоторых видов животных и человека. Первоначально считали, что действие как глюкагона, так и катехоламинов на активацию фосфорилазы опосредуется цАМФ; кальцию отводили дополнительную роль в стимуляции фосфорилазкиназы. Что касается глюкагона, то до сих пор еще полагают, что его влияние на печеночный гликогенолиз (и глюконеогенез) зависит от цАМФ, действующего, вероятно, в концентрациях, гораздо более низких, чем те, которые создаются при экспериментальной стимуляции печеночных клеток глюкагоном. Однако в отношении катехоламинов современные данные свидетельствуют о том, что в отличие от действия глюкагона стрессорные гормоны, такие, как катехоламины, вазопрессин и ангиотензин II, стимулируют гликогенолиз и глюконеогенез не через цАМФ, а с помощью других механизмов. Хотя адреналин активирует аденилатциклазу через печеночные b-адренергические рецепторы, повышая образование цАМФ, в настоящее время считают что влияние катехоламинов на печеночный гликогенолиз опосредуется главным образом a-адренергическими рецепторами и не зависит от цАМФ. Вместо этого a-адренергическая активация фосфорилазы зависит, по-видимому, от ионов кальция [47].
Вазопрессин и ангиотензин II также стимулируют печеночную фосфорилазу с помощью цАМФ-независимого механизма, в котором важную роль играет «кальциевый статус» гепатоцита, опосредующий действие всех трех стрессорных гормонов. Считают, что эти пептиды активируют печеночную фосфорилазу путем мобилизации внутриклеточных запасов кальция (что приводит к повышению его концентрации в цитозоле) и далее к стимуляции фосфорилазо-b-киназы [48]. Роль внутриклеточных источников кальция, мобилизуемого при действии гормонов, приписывают митохондриям, микросомам и плазматической мембране; в последней это является результатом ускоренного кругооборота фосфатидилинозитола. Современные данные свидетельствуют в пользу митохондриального кальциевого пула как источника, из которого катехоламины (а также вазопрессин и ангиотензин II) черпают кальций, поступающий в цитоплазму и внеклеточную жидкость. Это означает, что второй медиатор, образуемый гормонрецепторным взаимодействием в плазматической мембране, приводит к мобилизации внутриклеточных кальциевых запасов, увеличивая результирующий выход кальция из митохондрий [47]. При a-адренергической стимуляции печеночных клеток наблюдали и повышение уровня пГМФ, но это, вероятно, отражает изменения концентрации свободного внутриклеточного кальция и последующую активацию гуанилатциклазы. Функциональное значение эффектов гормонов этой группы на печень может заключаться в их связи с острым стрессом, поскольку они индуцируют печеночный гликогенолиз в таких концентрациях, которые присутствуют в крови лишь при шоке и обезвоживании [49].
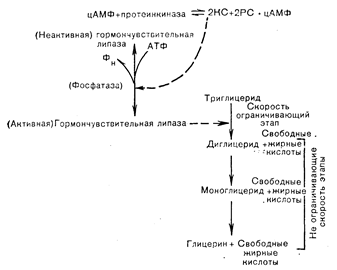
Рис. 4—14. Регуляция липолиза цАМФ-зависимой протеинкиназой. Активация гормончувствительной липазы путем фосфорилирования приводит к ускорению распада триглицеридов с образованием глицерина и свободных жирных кислот (по данным Steinberg и соавт. [5] в модификации). КС — каталитическая субъединица; PC — регуляторная субъединица. Фн — фосфор неорганический.
Помимо действия на гликолиз, обеспечивающего присутствие глюкозы как источника энергии, цАМФ играет также важнейшую роль в мобилизации свободных жирных кислот из жировой ткани. Это обусловливается фосфорилированием и активацией гормончувствительной липазы, которая регулирует скорость-ограничивающий этап гидролиза эфирных связей в процессе распада триглицеридов (рис. 4—14). Быстро действующие гормоны, в том числе глюкагон, адреналин и АКТГ, повышают активность гормончувствительной липазы путем фосфорилирования, которое определяется цАМФ-зависимой протеинкиназой. Поскольку жировая ткань содержит также фосфорилазу и гликогенсинтетазу, то присутствие трех ферментных систем, контролируемых цАМФ-зависимой протеинкиназой, повышает необходимость существования «пост-цАМФ овых» механизмов, которые регулировали бы и интегрировали отдельные ферментативные процессы, «запускаемые» протеинкиназой [50].
Дата добавления: 2015-01-19; просмотров: 2012;
