Механизм реакции электрофильного замещения
Этапы реакции:
- Приближение электрофила к ароматической делокализованной системе электронов
- Электрофил ориентируется перпендикулярно к бензольному кольцу , образует пи-комплекс
- Электрофил «забирает» два электрона из пи-электронной системы и образует сигма- комплекс, в котором остается 4 электрона на 5 атомов углерода( возникает рассредоточенный положительный заряд). Пять атомов углерода имеют sp2 –гибридное состояние., а один атом , связанный с заместителем и атомом водорода, в состоянии sp3
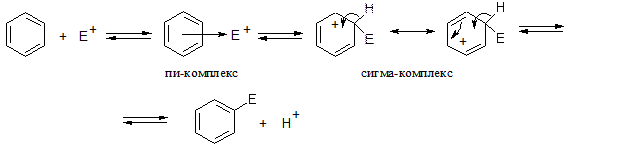 4. Чтобы вновь вернуть единую пи-электронную систему, надо в нее вернуть два электрона. Происходит « выброс» протона и два электрона возвращаются в общий ароматический секстет.
4. Чтобы вновь вернуть единую пи-электронную систему, надо в нее вернуть два электрона. Происходит « выброс» протона и два электрона возвращаются в общий ароматический секстет.
4.2.4. Реакции нуклеофильного замещения ( S N )
Реакции нуклеофильного замещения заключаются в вытеснении нуклеофильной частицы, связанной с атомом углерода, другой нуклеофильной частицей.
В общем виде можно представить:
У – + R –> X <==> R –> У + X–
 | б+ б- б- | б+
| б+ б- б- | б+
У – + – C –> Х <==> У <– C – + Х –
нуклеофил(1) | | нуклеофил(2)
приходящая уходящая группа
группа
Нуклеофил должен иметь доступную электронную пару ( это может быть анион или молекула, в которой есть атом с неподеленной парой электронов) и атаковать другую молекулу по электрофильному центру, замещая имеющуюся нуклеофильную группу.
Наиболее распространенными in vitro являются превращения :
А. Обратимая реакция: спирт – галогенопроизводное / галогенопроизводное –спирт
R-OH + Н Hal <==> R- Hal + Н2 О
Б. Галогенопроизводное - цианопроизводное
R- Hal + Н- CN ——> R- CN + ННа1
В. Галогенопроизводное - амин
R- Hal + N H3 ——> R- N H2 + НС1
Г. Этерификация ( карбоновая кислота- сложный эфир )
R COOH + R1 ОН <==> R COOR1 + Н2 О
Д. Переэтерификация ( сложный эфир - другой сложный эфир )
R COOR1 + R2 ОН <==> R COOR2 + R1 ОН
Е. Амидирование ( сложный эфир - амид )
R COOR1 + N H3 <==> R CO N H2 + R1 ОН
Ж. Гидролиз ( сложный эфир – кислота, амид - кислота)
R COOR1 + Н2 О <==> R COOH + R1 ОН
R CO N H2 + Н2 О <==> R COOH + N H3
З . Образование ангидрида
R COOH + R COOH <==> R C- O- С R + Н2 О
| | | |
О О
В биохимических процессах in vivo встречаются реакции ( Д – З ).
Выделяют реакции SN 1 и SN 2, которые различаются между собойобразованием переходных состояний , и , вследствие этого, могут сопровождаться изомерными отличиями в пространственном строении продуктов реакции.
Реакция S N 2.- бимолекулярная
В образовании переходного состояния участвуют оба нуклеофила : « приходящий и уходящий». Процесс присоединения одного и удаления другого – синхронный: один нуклеофил с противоположной стороны подходит, а другой уходит. Если атом углерода в электрофильном центре , у которого происходит замещение, был оптически активным, то обязательно изменяется пространственное строение – смена одного стереоряда на другой.
 |  |
| б+ б- + |
У – + –- C –> Х <==> У – … >С– … Х– <==> У – С – + Х –
| атом углерода |
атом углерода тригональный плоское атом углерода
тетраэдрический строение тетраэдрический
карбокатион – изменение стереоряда
Дата добавления: 2015-03-26; просмотров: 1315;
