Строение атома и химические свойства элементов
Индивидуальность элемента определяется зарядом его ядра атома. Химические свойства элемента определяются строением его электронной оболочки. Так как внешние электронные оболочки имеют периодически повторяющееся количество электронов, то имеет место периодическая зависимость свойств простых веществ и соединений элементов от заряда ядра атома.
Совокупность элементов, имеющих одинаковое количество электронных энергетических уровней, составляет период, а элементы, имеющие одинаковое строение внешнего и предвнешнего энергетических уровней, образуют группы периодической системы Менде-леева.
Химические свойства простых веществ, их способность вступать в химические реакции определяются количеством электронов на внешнем электронном уровне атома данного элемента, а также удаленностью этого уровня от ядра атома.
Металлические свойства простых веществ определяются способностью атомов отдавать электроны.
Рассмотрим способность отдавать электроны элементами 1-й группы главной подгруппы (главными называются подгруппы, образованные элементами, имеющими одинаковое строение внешних и предвнешних электронных слоев с элементами I и II периодов и расположенные в периодической системе строго по вертикали под ними). Можно заметить, что у этих элементов имеется по 1 электрону на s-подуровне внешнего энергетического уровня. Удаленность энергетического уровня от ядра, а, следовательно, и размер атома будет увеличиваться:
3Li 1s22s1
11Nа 1s22s22p63s 1
19К 1s22s22p6 3s23p64s1
37Rв 1s22s22p6 3s23p64s23d104p65s2
55Cs 1s22s22p6 3s23p64s23d104p65s24d105p66s2
87Fr 1s22s22p6 3s23p64s23d104p65s24d105p66s24f145d106p67s2.
Внешнее электронное облако у атома франция, имеющее максимальные размеры, будет обладать минимальной плотностью, и энергия, необходимая для удаления электрона из поля атома, будет минимальной.
Энергия, необходимая для отрыва электрона от атома, называется энергией ионизации (I).
В результате ионизации атом превращается в положительно заряженный ион:
Э0 – е → Э+.
Энергия ионизации (I) измеряется в электрон-вольтах (или кДж/моль) и является мерой восстановительной способности элемента (характеристикой металлических свойств). Чем меньше энергия ионизации, тем сильнее выражена восстановительная способность элемента.
С увеличением заряда ядра радиусы атомов меняются периодически. У элементов одного периода при переходе от щелочного металла к благородному газу, с ростом заряда ядра и числа внешних электронов усиливается их взаимное притяжение, и радиусы атомов уменьшаются. При этом возрастает величина энергии ионизации и энергии сродства к электрону. Поэтому к концу периода металлические свойства элементов ослабевают, а неметаллические усиливаются.
Для элементов одной подгруппы, имеющих одинаковое строение внешнего электронного слоя, с ростом порядкового номера число электронных слоев и радиус атома возрастают. При этом притяжение внешних электронов к ядру ослабевает. Это приводит к уменьшению энергии ионизации и усилению металлических свойств.
Радиус катиона, образующегося при отрыве электронов от электронейтрального атома, меньше чем радиус соответствующего атома.
Радиус аниона, образующегося при присоединении электронов к электронейтральному атому, больше чем радиус соответствующего атома.
В главных подгруппах с увеличением порядкового номера элемента радиус атома увеличивается, а энергия ионизации уменьшается, восстановительная активность s- и p-элементов увеличивается. В побочных подгруппах при увеличении порядкового номера энергия ионизации увеличивается, восстановительная активность d-элементов снижается.
Неметаллические свойства простых веществ (т.е. способность принимать электроны на внешнюю электронную оболочку атома), характеризуется величиной энергии сродства к электрону.
Энергией сродства к электрону (Ее) называется энергия, выделяющаяся при присоединении электрона к атому с превращением его в отрицательный ион:
Э + ē → Э–.
Энергия сродства к электрону Ее измеряется в электрон-вольтах (или кДж/моль) и является мерой окислительной способности элемента (мерой неметаллических свойств). Чем больше Ее, тем сильнее выражены окислительные (неметаллические) свойства элемента. С увеличением порядкового номера элемента Ее по периодам возрастает, по группам уменьшается.
В периодической системе элементов Д.И. Менделеева энергия сродства к электрону будет увеличиваться снизу вверх в главных подгруппах и слева направо в периодах:
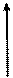 |
|
17Cl 1s22s22p63s23p5
35Br 1s22s22p63s23p64s23d104p5
Например, среди галогенов фтор, находящийся во втором периоде, легче притянет электрон на внешнюю электронную оболочку, чем йод, у которого внешняя электронная оболочка состоит из того же количества электронов, но обладает большими размерами. Среди элементов периодической системы наибольшее сродство к электрону имеют фтор, кислород, хлор. Они же являются и самими сильными окислителями и типичными неметаллами.
Обобщенную характеристику элемента, включающую и величину энергии ионизации и величину энергии сродства к электрону дает электроотрицательность.
Электроотрицательность характеризует способность атома притягивать электронную плотность от других атомов при образовании химической связи.
Те атомы, которые легко теряют свои электроны, называют электроположительными, а атомы, принимающие электроны – электроотрицательными. В начале каждого периода находятся элементы с наиболее низкой электроотрицательностью – типичные металлы. В конце периода (перед благородным газом) находятся элементы с наивысшей электроотрицательностью – типичные неметаллы. Самый электроотрицательный элемент – фтор, самый электроположительный – франций.
Часто используются не абсолютные значения электроотрицательности в электрон-вольтах или кДж/моль, а относительные безразмерные значения, так называемая относительная электроотрицательность (ОЭО). Значения величин относительных электроотрицательностей ряда элементов приведены в табл. 14 приложения.
Характер изменения энергии ионизации J, энергии сродства к электрону Ее и относительной электроотрицательности ЭО с возрастанием порядкового номера элемента в Периодической системе элементов Д.И. Менделеева приведен на рис. 4.9.
 По периоду величины I, Ee и ОЭО увеличиваются
По периоду величины I, Ee и ОЭО увеличиваются
(металлические свойства ослабевают, неметаллические свойства
Дата добавления: 2015-03-23; просмотров: 2227;
