В атомах элементов главных подгрупп валентные электроны находятся на s- и р-подуровнях внешнего энергетического уровня и общее их число равно номеру группы.
В главных подгруппах при переходе сверху вниз усиливаются металлические свойства, основной характер соединений и их устойчивость в низшей степени окисления. Например, для элементов IV А-группы возможные степени окисления +2 и +4. Для углерода наиболее характерна степень окисления +4, поэтому четырехвалентные соединения углерода устойчивы и не проявляют окислительных свойств. У свинца металлические свойства выражены сильнее, чем у углерода и для него характерна степень окисления +2, вследствие чего соединения свинца со степенью окисления +4 являются окислителями.
В побочных (В) подгруппах располагаются d- и f-элементы. Валентные электроны в атомах d-элементов находятся на s-под-уровне внешнего и d-подуровне предвнешнего энергетических уровней. В побочных подгруппах, кроме подгруппы скандия, при переходе сверху вниз металлические свойства ослабевают, а кислотный характер соединений и их устойчивость в высшей степени окисления усиливаются.
d-элементы побочных подгрупп склонны проявлять переменную степень окисления. Характер образуемых ими соединений зависит от степени окисления элемента.
Если элементы образуют несколько соединений, то соединения, в которых элемент находится в низшей степени окисления, имеют основной характер, в высшей степени окисления – кислотный, а в промежуточной – чаще всего амфотерный.
Например, хром проявляет степени окисления +2, +3, +6 и характер образуемых им оксидов следующий:
Cr+2O 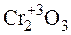 Cr+6O3
Cr+6O3
Дата добавления: 2015-03-23; просмотров: 3507;
