Неметаллические свойства ослабевают)
Рис. 4.9. Характер изменения энергии ионизации I, энергии сродства к электрону Ее и электроотрицательности ЭО с возрастанием порядкового номера элемента.
Таким образом, с увеличением порядкового номера элемента в главных подгруппах энергия ионизации будет уменьшаться, а металлические свойства усиливаться. В то же время, с увеличением порядкового номера элементов, находящихся в одном периоде, возрастающий заряд ядра все более сильно притягивает к себе электроны, что приводит к некоторому уменьшению размера атома, возрастанию энергии ионизации и ослаблению металлических свойств.
Было замечено, что, вступая в химическое взаимодействие, атомы стремятся отдать или принять электроны так, чтобы внешняя электронная оболочка имела бы устойчивую восьмиэлектронную конфигурацию благородного газа (правило октета). Поэтому атомы, имеющие на внешней электронной оболочке один, два или три электрона преимущественно отдают их в химических реакциях и проявляют металлические свойства:
11Nа (1s22s22p6 3s1) - 1 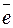 → 11Nа + (1s22s22p6),
→ 11Nа + (1s22s22p6),
12Mg (1s22s22p6 3s2) - 2 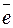 → 12Mg +2 (1s22s22p6),
→ 12Mg +2 (1s22s22p6),
13Al (1s22s22p6 3s23p1) - 3 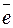 → 13Al +3 (1s22s22p6).
→ 13Al +3 (1s22s22p6).
Атомы, имеющие на внешней электронной оболочке пять, шесть или семь электронов, стремятся дополнить ее до устойчивого октета и проявляют неметаллические свойства:
7N (1s22s22p3 ) + 3 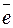 → 7N-3 (1s22s22p6)
→ 7N-3 (1s22s22p6)
17Сl (1s22s22p6 3s23p5) + 1 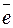 → 17Сl- (1s22s22p6 3s23p6).
→ 17Сl- (1s22s22p6 3s23p6).
Обобщая вышесказанное, можно отметить, что в периодической системе Д.И. Менделеева металлические свойства простых веществ увеличиваются сверху вниз и справа налево, а неметаллические соответственно увеличиваются снизу вверх и слева направо. Самым активным металлом является франций, самым активным неметаллом - фтор.
Водород по своим свойствам занимает особое положение. У него всего 1 электрон на внешней оболочке; то есть он должен быть помещен в 1 группу. Однако, этот единственный электрон не экранирован от ядра другим электронными слоями, очень сильно притянут к ядру, что определяет специфические свойства водорода. В отличие от остальных элементов первой группы водород - неметалл. Поэтому его символ и помещают в VII группе, показывая тем самым, что для заполнения электронного слоя ему необходим всего один электрон, как фтору и его аналогам.
Дата добавления: 2015-03-23; просмотров: 1997;
