Валентность I
1 p
s
На втором энергетическом уровне у атома бора 3 электрона, поэтому он образует ион В+3.
Электронная и электронно-графические формулы атома углерода 6С в нормальном состоянии имеют вид:
6С 1s22s22р2.
 | ||
 |
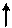
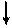 2 Валентность II
2 Валентность II
1 р
s
В возбужденном состоянии атом углерода 6С٭ за счет перехода электрона с орбитали 2s на орбиталь 2р будет иметь следующие электронные и электронно-графические формулы:
Электронная формула:
6С٭ 1s22s12р3
Электронно-графическая формула:
 | |||||
 | |||||
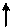 | |||||
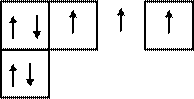 2 Валентность IV
2 Валентность IV
1 р
s
Поэтому, углерод в своих соединениях может быть либо двух-, либо четырехвалентен.
Следует обратить внимание на то, что при возбуждении
могут распариваться электроны только внешнего электронного уровня, если на нем есть свободные орбитали.
У атома углерода внешний энергетический уровень наполовину заполнен, поэтому возможна и отдача 4-х электронов с образованием иона С+4 (1s2 2s2 2р0) и присоединение электронов для максимального заполнения p-подуровня второго энергетического уровня с образованием иона С-4 (Is2 2s2 2р6).
Атом кислорода 8О 1s22s22р4 имеет на внешнем энергетическом уровне два неспаренных электрона, что обусловливает его валентность, равную двум. Это видно изэлектронно-графической формулы атома кислорода в нормальном состоянии:
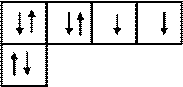
1 pВалентность II
s
Атому кислорода 8О, имеющему на внешнем энергетическом уровне 6 электронов (1s22s22р4) легче достроить внешнюю электронную оболочку, приняв два электрона. При этом у иона кислорода О-2 появляется устойчивая завершенная электронная оболочка благородного газа неона - 1s22s22р6:
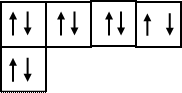 2
2
p
1
s
Второй энергетический уровень имеет два подуровня, поэтому возбуждение для атома кислорода невозможно и валентность атома кислорода имеет постоянное значение, равное двум.
Aтом фтора, образуя соединения с другими элементами, способен принимать только один электрон:
9F 1s22s22р5.
Атом неона имеет на внешнем энергетическом уровне 8 электронов:
10Ne 1s22s22р6.
Такая полностью завершенная (s2р6) оболочка (октет) характеризуется высокой инертностью, поэтому неон - малоактивное вещество, «благородный газ».
Начиная с III периода, у атомов идет заполнение третьего энергетического уровня, имеющего уже три подуровня – s, p и d.
Электронная конфигурация атома натрия, открывающего III период, который характеризуется наличием трех подуровней, будет иметь вид:
11Na 1s22s22р63s1.
| | |||
 | |||
d
p
s
Атом натрия имеет один неспаренный электрон на s подуровне, т.е. является s – элементом и проявляет валентность, равную I.
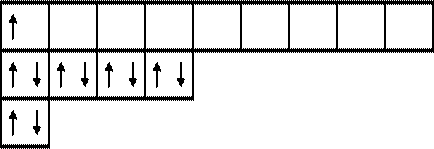
Электронная и электронно-графические формулы атома фосфора (p-электронное семейство) имеют вид:
15P 1s22s22p63s23p3,

 3
3
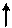 | 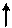 |
2 d
1 p
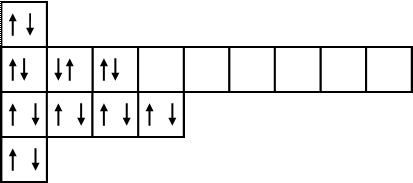
Электронная конфигурация атома кальция (s-электронное семейство):
20Ca 1s22s22p6 3s23p64s2.
Электронно-графическая формула атома кальция:
 |
4
3
2 d
p
1s
s
 Следует заметить, что у атома кальция, в соответствии с принципом наименьшей энергии, сначала заполняется подуровень 4s, а лишь затем подуровень 3р.
Следует заметить, что у атома кальция, в соответствии с принципом наименьшей энергии, сначала заполняется подуровень 4s, а лишь затем подуровень 3р.
Химические свойства атомов определяются, в основном, строением внешних энергетических уровней, которые называются валентными. На подуровнях этих уровней находятся или неспаренные электроны, или электроны, которые могут стать неспаренными в возбужденном состоянии.
Полностью завершенные энергетические уровни обусловливает малую химическую активность обладающих ими атомов.
Часто графически изображают не всю электронную формулу, а лишь те подуровни, на которых находятся валентные электроны (сокращенные электронные и электронно-графические формулы).
Например, для атома серы краткая электронная формула:
16S…3s2 3p4
Сокращенная электронно-графическая формула атома серы:
 |
S p
Краткая электронная формула для атома ванадия:
23V…3d 34s2.
При графическом изображении электронной конфигурации атома в возбужденном состоянии, наряду с заполненными, изображают вакантные валентные орбитали.
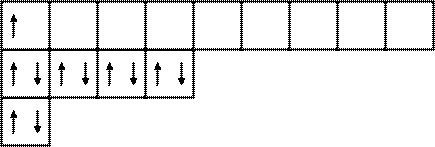
Например, в атоме фосфора на третьем энергетическом уровне имеются одна s-атомная орбиталь, три р-АО и пять d-АО. Электронная конфигурация атома фосфора в основном состоянии имеет вид:
Электронно-графическая формула атома фосфора (p-электронное семейство) имеет вид:
15P 1s22s22p63s23p3,
 |

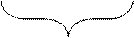 |  | ||
3s 3p 3d
Валентность фосфора, определяемая числом неспаренных электронов, в основном состоянии равна 3. При переходе атома в возбужденное состояние происходит распаривание электронов состояния 3s и один из электронов с s-подуровня может перейти на 3d-подуровень:
Р*… 3s2 3p3 3d1.
 |
S p d
При этом валентность фосфора меняется с трех в основном состоянии до пяти в возбужденном.
Дата добавления: 2015-03-23; просмотров: 2210;
