Уровни Подуровни
Рис. 4.8. Энергия атомных орбиталей.
Элементы, у атомов которых в последнюю очередь заполняется s-подуровень внешнего уровня, называются s-элементами. У s-эле-ментов валентными являются s-электроны внешнего энергетического уровня.
У р-элементов последним заполняется р-подуровень внешнего уровня. У них валентные электроны расположены на p- и s-под-уровнях внешнего уровня. У d-элементов в последнюю очередь заполняется d-подуровень предвнешнего уровня и валентными являются s-электроны внешнего и d-электроны предвнешнего энергетического уровней.
У f-элементов последним заполняется f-подуровень третьего снаружи энергетического уровня.
Порядок размещения электронов в пределах одного подуровня определяется правилом Гунда:
в пределах подуровня электроны размещаются таким образом, чтобы сумма их спиновых квантовых чисел имела бы максимальное значение по абсолютной величине.
Иными словами, орбитали данного подуровня заполняются сначала по одному электрону с одинаковым значением спинового квантового числа, а затем по второму электрону с противоположным значением.
Например, если в трех квантовых ячейках необходимо распределить 3 электрона, то каждый из них будет располагаться в отдельной ячейке, т.е. занимать отдельную орбиталь:
 |
В этом случае сумма спиновых квантовых чисел максимальна:
∑ms= ½ + ½ + ½ = 3/2.
Эти же 3 электрона не могут быть расположены иначе, так как ∑ms будет меньше, например:
 |
∑ms= ½ – ½ + ½ = ½.
Порядок распределения электронов по энергетическим уровням и подуровням в оболочке атома называется его электронной конфигурацией, или электронной формулой. Составляя электронную конфигурацию номер энергетического уровня (главное квантовое число) обозначают цифрами 1, 2, 3, 4…, подуровень (орбитальное квантовое число) – буквами s, p, d, f. Число электронов на подуровне обозначается цифрой, которая записывается вверху у символа подуровня.
Электронная конфигурация атома может быть изображена в виде так называемой электронно-графической формулы. Эта схема размещения электронов в квантовых ячейках, которые являются графическим изображением атомной орбитали. В каждой квантовой ячейке может быть не более двух электронов с различными значениями спиновых квантовых чисел.
Чтобы составить электронную или электронно-графическую формулу любого элемента следует знать:
1. Порядковый номер элемента, т.е. заряд его ядра и соответствующее ему число электронов в атоме.
2. Номер периода, определяющий число энергетических уровней атома.
3. Квантовые числа и связь между ними.
Так, например, атом водорода с порядковым номером 1 имеет 1 электрон. Водород - элемент первого периода, поэтому единственный электрон занимает находящуюся на первом энергетическом уровне s-орбиталь, имеющую наименьшую энергию. Электронная формула атома водорода будет иметь вид:
1Н 1s1.
Электронно-графическая формула водорода будет иметь вид:
 1H 1s
1H 1s
Электронная и электронно-графическая формулы атома гелия:
2Не 1s2
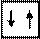 2Не 1s
2Не 1s
отражают завершенность электронной оболочки, что обусловливает ее устойчивость. Гелий – благородный газ, характеризующийся высокой химической устойчивостью (инертностью).
Атом лития 3Li имеет 3 электрона, это элемент II периода, значит, электроны расположены на 2-х энергетических уровнях. Два электрона заполняют s - подуровень первого энергетического уровня и 3-й электрон расположен на s - подуровне второго энергетического уровня:
 3Li 1s22s1
3Li 1s22s1
Дата добавления: 2015-03-23; просмотров: 2604;
