Спаренные электроны
Если на орбитали находится один электрон, то он называется неспаренным, а если два – то это спаренные электроны.
Четыре квантовых числа n, l, m, ms полностью характеризуют энергетическое состояние электрона в атоме.
Рассматривая строение электронной оболочки многоэлектронных атомов различных элементов, необходимо учитывать три основных положения:
· принцип Паули,
· принцип наименьшей энергии,
· правило Гунда.
Согласно принципу Паули в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Принцип Паули определяет максимальное число электронов на одной орбитали, уровне и подуровне. Так как АО характеризуется тремя квантовыми числами n, l, m, то электроны данной орбитали могут различаться только спиновым квантовым числом ms. Но спиновое квантовое число ms может иметь только два значения +1/2 и –1/2. Следовательно, на одной орбитали может находиться не более двух электронов с различными значениями спиновых квантовых чисел.
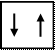
Рис. 4.6. Максимальная емкость одной орбитали – 2 электрона.
Максимальное число электронов на энергетическом уровне определяется как 2n2, а на подуровне – как 2(2l + 1). Максимальное число электронов, размещающихся на различных уровнях и подуровнях, приведено в табл. 4.1.
Таблица 4.1.
Максимальное число электронов на квантовых уровнях и подуровнях
| Энергети-ческий уровень | Энергети-ческий подуровень | Возможные значения магнитного квантового числа m | Число орбиталей на | Максимальное число электронов на | ||
| подуровне | уровне | подуровне | уровне | |||
| K (n=1) | s (l=0) | |||||
| L (n=2) | s (l=0) p (l=1) | –1, 0, 1 | ||||
| M (n=3) | s (l=0) p (l=1) d (l=2) | –1, 0, 1 –2, –1, 0, 1, 2 | ||||
| N (n=4) | s (l=0) p (l=1) d (l=2) f (l=3) | –1, 0, 1 –2, –1, 0, 1, 2 –3, –2, –1, 0, 1, 2, 3 |
Последовательность заполнения электронами орбиталей осуществляется в соответствии с принципом наименьшей энергии.
Согласно прнципу наименьшей энергии электроны заполняют орбитали в порядке повышения их энергии.
Очередность заполнения орбиталей определяется правилом Клечковского: увеличение энергии и, соответственно, заполнение орбиталей происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равной сумме (n + l) – в порядке возрастания главного квантового числа n.
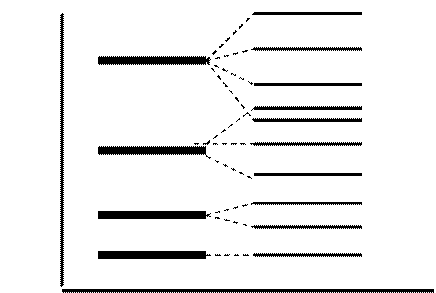
Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае сумма n + l = 4 + 0 = 4 (напомним, что для s-подуровня значение орбитального квантового числа l = = 0), а во втором n + l = 3 + 2= 5 (d - подуровень, l = 2). Поэтому, сначала заполняется подуровень 4s, а затем 3d (см. рис. 4.8).
На подуровнях 3d (n = 3, l = 2) , 4р (n = 4, l = 1) и 5s (n = 5, l = 0) сумма значений п и l одинаковы и равны 5. В случае равенства значений сумм n и l сначала заполняется подуровень с минимальным значением n, т.е. подуровень 3d.
В соответствии с правилом Клечковского энергии атомных орбиталей возрастает в ряду:
1s < 2s < 2р < 3s < 3р < 4s < 3d < 4р < 5s < 4d < 5p < 6s < 5d »
»4f < 6p < 7s….
В зависимости от того, какой подуровень в атоме заполняется в последнюю очередь, все химические элементы делятся на 4 электронных семейства: s-, p-, d-, f-элементы.

 4f
4f
44d
4p
3d
3 4s
3p
3s
2 2p
2s
1s
Дата добавления: 2015-03-23; просмотров: 1716;
