Внутренняя энергия термодинамической системы
В механике вводится понятие работа, которая в системе СИ измеряется в джоулях. Работа – это произведение силы на расстояние, т.е.
1 Дж = 1 Н · 1 м.
По определению энергия – это возможность совершения работы (в греческом энергия означает деятельность).
Всякая термодинамическая система в любом состоянии обладает запасом внутренней энергии.
Все термодинамические системы состоят из множества элементов (атомов, молекул и т.п.).
Внутренняя энергия системы – это суммарная энергия всех её элементов.
Внутренняя энергия системы экспериментально определяется в такой системе координат, в которой сама термодинамическая система как целое покоится
Пример: Для объема идеального газа, состоящего из молекул - упругих сфер, внутренняя энергия равна сумме кинетических энергий всех молекул газа в системе координат, жестко привязанной к центру масс (ЦМ) этого объема.
Для реального газа к кинетической энергии молекул следует добавить: потенциальную энергию взаимодействия между молекулами; вращательную и колебательную энергию молекул; энергию электронов; энергию ядер и др.
Примечание:
Термодинамический анализ опирается на феноменологический подход. Поэтому при рассмотрении явлений на макроуровне нет необходимости знать микроструктуру внутренней энергии. Например, из опыта известно, что для анализа процессов энергообмена между термодинамической системой и окружающей средой достаточно иметь сведения об изменении основных параметров состояния системы р, υ и Т. То есть можно говорить, что внутренняя энергия простой системы зависит только от её состояния и, следовательно, однозначно определяется любыми двумя (из трёх) параметров состояния р, υ и Т. (В случае сложных, например, многофазных систем вводится соответствующие дополнительные параметры).
Экспериментально установлено, что внутренняя энергия любой простой термодинамической системы U, Дж, состоит из двух слагаемых. Одно из этих слагаемых является непрерывной функцией двух параметров состояния, например, р и Т. Второе слагаемое не зависит от параметров состояния.
Таким образом, можем записать:
U (р, Т) = Е (р, Т) + const. (4.1)
где U (р, Т) – внутренняя энергия системы, которая является непрерывной функцией двух параметров состояния или, для краткости, просто является функцией состояния, Дж; Е (р, Т) – часть внутренней энергии, которая зависит от параметров состояния, Дж; const – часть внутренней энергии, которая не зависит от параметров состояния (энергия ядер, энергия потенциального взаимодействия между молекулами и др.), Дж.
Неопределенность, которая возникает в (4.1) из-за неизвестной константы (второго слагаемого) представляет собой существенную особенность понятия внутренняя энергия. Но так как на практике всегда рассматривается только изменение энергии в ходе процесса, то есть конечная разность энергий (либо бесконечно малое её изменение – дифференциал), то эта константа не влияет на окончательный результат.
В термодинамике обычно пользуются удельными величинами:
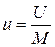 , (4.2)
, (4.2)
где U – внутренняя энергия системы, Дж; u – удельная внутренняя энергия системы, Дж/кг; М – масса системы, кг.
Удельная внутренняя энергия различных веществ определяется экспериментально и приводится в таблицах справочной литературы, например, как функция р и Т.
Дата добавления: 2015-03-19; просмотров: 1922;
