Энтальпия. Для удобства проведения расчётов в термодинамике помимо внутренней энергии вводится ещё одна функция состояния э н т а л ь п и я I (от греческого нагреваю):
Для удобства проведения расчётов в термодинамике помимо внутренней энергии вводится ещё одна функция состояния э н т а л ь п и я I (от греческого нагреваю):
I = U + p V, (5.1)
где U – внутренняя энергия системы, Дж; p – абсолютное давление в системе, Па; V – объём, который занимает система, м3.
Разделив обе части (5.1) на массу системы М, кг, получим формулу для удельной энтальпии i:
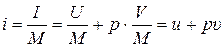 , (5.2)
, (5.2)
где υ – удельный объем системы (параметр состояния), м3/кг.
Выражение (5.2) можно считать определением удельной энтальпии термодинамической системы.
Из (5.2) очевидно, что i является непрерывной функцией параметров состояния или функцией состояния, так как в правой части оба слагаемые являются непрерывными функциями параметров состояния р и υ. Другими словами, если нам известны значения двух любых параметров состояния, например, р и υ, то этого достаточно, чтобы определить значение i.
Также из (5.2) очевидно, что энтальпия по физическому смыслу является как бы вторичной функцией от внутренней энергии. Значения удельных энтальпий различных веществ определены экспериментально и приводятся в справочных таблицах.
Дата добавления: 2015-03-19; просмотров: 775;
