Энтальпия. В уравнении энергии термодинамической системы (1.5) внутренняя энергия U и потенциальная энергия в поле сил давления pV характеризуют физическое состояние
В уравнении энергии термодинамической системы (1.5) внутренняя энергия U и потенциальная энергия в поле сил давления pV характеризуют физическое состояние системы, допустимо их объединить и представить в виде некоторой функции состояния – э н т а л ь п и и. Название «энтальпия», которое было введено в термодинамику Д. Гиббсом, происходит от греческого слова “нагревать”.
Калорический параметр термодинамической системы, равный сумме внутренней энергии и энергии в поле сил давления, называется энтальпией.
Энтальпия обозначается I. Согласно определению:
I = U + pV. (1.6)
За единицу энтальпии принят джоуль.
С учетом выражения (1.6) уравнение энергии термодинамической системы запишется в виде:
Е = I + m 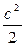 . (1.7)
. (1.7)
Если система неподвижна, то энтальпия равна полной энергии системы объемом V, находящейся под давлением р.
Энтальпия является одной из вспомогательных функций, использование которых значительно упрощает термодинамические расчеты. Она не может быть измерена непосредственно, а определяется, как и внутренняя энергия, только расчетным путем.
Внутренняя энергия и энтальпия характеризуются рядом общих свойств:
1) Внутренняя энергия и энтальпия как функции состояния являются неодинаковыми для разных систем и тел, входящих в систему, т.е. являются не универсальными, а индивидуальными параметрами для каждого вещества.
2) Абсолютные значения внутренней энергии и энтальпии определяются с точностью до постоянных U0 и I0, выбранных в качестве стандартных. Так, в состоянии а абсолютные значения U и I запишутся следующим образом:
Uа= Uа-0 + U0 и Ia = Ia-0 +I0 .
В термодинамике, как правило, искомой величиной является изменение внутренней энергии и энтальпии, поэтому выбор стандартного состояния для определения ∆ U и ∆ I может быть произвольным.
3) Внутренняя энергия и энтальпия являются экстенсивными (аддитивными) величинами. Для системы, заданной несколькими телами, внутренняя энергия и энтальпия равны, соответственно, сумме внутренних энергий и энтальпий отдельных тел, т.е.
Uc = 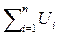 и Ic =
и Ic = 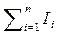 .
.
Однако удельные значения внутренней энергии и энтальпии относятся к интенсивным параметрам. Удельные массовые значения внутренней энергии и энтальпии вычисляют с помощью соотношений:
u =U/m и i = I/m
и выражают в Дж/кг.
1.1.5. Теплота и работа – формы энергообмена
Обмен энергией между закрытой термодинамической системой и внешней средой или между телами внутри системы может осуществляться посредством двух качественно различных форм. Одна форма обмена энергией происходит без видимого перемещения тел и системы в целом, другая - сопровождается изменением ее размеров или расположения ее тел в пространстве.
Для процессов, изучаемых в технической термодинамике, первый способ передачи энергии может быть реализован только при хаотическом, ненаправленном движении микрочастиц внутри неравновесной системы или при обмене энергией термодинамической системы и окружающей среды, имеющих разные температуры. Такую форму называют т е п л о о б м е н о м. Для количественной оценки теплообмена введено понятие т е п л о т ы.
Дата добавления: 2015-02-16; просмотров: 983;
