Энтальпия
В термодинамике важную роль играет сумма внутренней энергии системы U и произведения давления системы р на ее объем V, называемая энтальпией и обозначаемая Н:
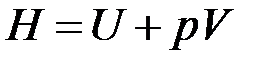 .
.
Так как входящие в нее величины являются функциями состояния, то и сама энтальпия является функцией состояния. Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж).
Энтальпия обладает свойством аддитивности. Величина
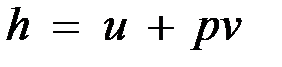 ,
,
называемая удельной энтальпией (h = H/M), представляет собой энтальпию системы, содержащей 1 кг вещества, и измеряется в Дж/кг.
Поскольку энтальпия есть функция состояния, то она может быть представлена в виде функции двух любых параметров состояния:
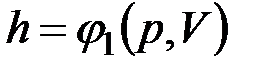 ;
; 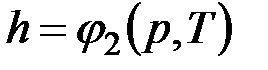 ;
; 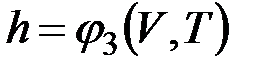 ,
,
а величина dh является полным дифференциалом.
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса.
Физический смысл энтальпии выясним на следующем примере. Рассмотрим расширенную систему, включающую газ в цилиндре и поршень с грузом общим весом G (Рис 4.1).
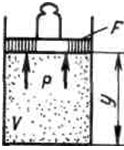
Рис. 4.1 Газ в цилиндре и поршень с грузом общим весом G .
Энергия этой системы складывается из внутренней энергии газа и потенциальной энергии поршня с грузом в поле внешних сил: 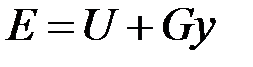 . В условиях равновесия (G = pF) эту функцию можно выразить через параметры газа:
. В условиях равновесия (G = pF) эту функцию можно выразить через параметры газа: 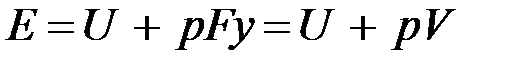 . Получаем, что
. Получаем, что 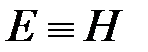 , т.е. энтальпию можно трактовать как энергию расширенной системы.
, т.е. энтальпию можно трактовать как энергию расширенной системы.
Уравнение 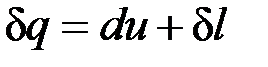 в случае, когда единственным видом работы является работа расширения, с учетом очевидного соотношения
в случае, когда единственным видом работы является работа расширения, с учетом очевидного соотношения 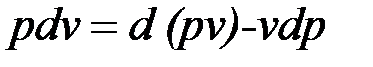 может быть записано в виде
может быть записано в виде
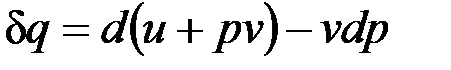 ,
,
или
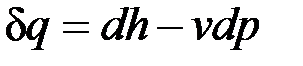 .
.
Из этого соотношения следует, что если давление системы сохраняется неизменным, т. е. осуществляется изобарный процесс (dp=0), то
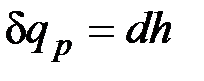 и
и 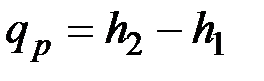 .
.
т. е. теплота, подведенная к системе при постоянном давлении, идет только на изменение энтальпии данной системы.
Это выражение очень часто используется в расчетах, так как огромное количество процессов подвода теплоты в теплоэнергетике (в паровых котлах, камерах сгорания газовых турбин и реактивных двигателей, теплообменных аппаратах), а также целый ряд процессов химической технологии и многих других осуществляется при постоянном давлении. Кстати, по этой причине в таблицах термодинамических свойств обычно приводятся значения энтальпии, а не внутренней энергии.
Для идеального газа с учетом получим
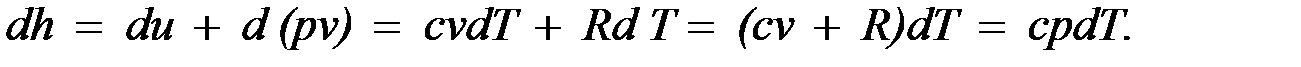
Так как между энтальпией и внутренней энергией существует связь 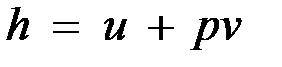 , выбор начала отсчета одной из них не произволен: в точке, принятой за начало отсчета внутренней энергии,
, выбор начала отсчета одной из них не произволен: в точке, принятой за начало отсчета внутренней энергии,
h = pv.
Например, для воды при t=0.01ºC и р =610,8 Па, u = 0, a
h = pv = 0,611 Дж/кг.
При расчетах практический интерес представляет изменение энтальпии в конечном процессе:
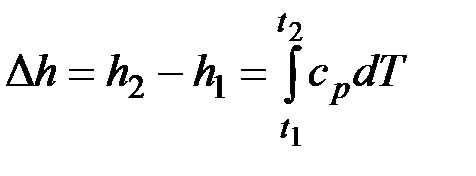 .
.
Дата добавления: 2015-02-16; просмотров: 2222;
