Электромиограмма при патологии центральной нервной системы
Использование ЭМГ и исследований проводимости по нервам для оценки функционального состояния ЦНС получило название центральной ЭМГ. Поскольку моторная единица является конечным общим путем для всех нервных импульсов, контролирующих скелетную мускулатуру, нарушения двигательного контроля в результате поражений центральной нервной системы вызывают образование патологических импульсов в моторных невронах, которые могут быть зарегистрированы с помощью электрофизиологической техники. Так, например, поверхностная ЭМГ, регистрирующая импульсы от соответствующих пар антагонистических мышц, регистрирует по сути «мобилизацию» отдельных моторных единиц, а микронейрографические исследования оказываются целесообразными при оценке различных типов тремора, включая тремор покоя при болезни Паркинсона, эссенциальный семейный тремор и физиологический тремор. С помощью этих методов церебеллярную атаксию можно отдифференцировать от других видов тремора и от сенсорной атаксии. Астериксис, таким образом, можно отличить от тремора, а также выявить различные типы миоклонуса. Изучение проприоцептивных и экстероцептивных рефлексов способствует дифференциальной диагностике расстройств движения, позволяя отличить спастичность от других видов ригидности. Исследование Н-рефлексов и F-реакций дает информацию относительно возбудимости моторного нейронного пула. Влияние вибрации на Н-рефлекс было использовано для оценки пресинаптического торможения при различных неврологических заболеваниях. Исследования так называемого периода затишья помогли оценить функции проприоцептивных «подводов» к мышечным «осям». Несоответствие информации от мышечных «осей» и от суставных рецепторов может привести к явной «церебеллярной» атаксии у больных с острой воспалительной полиневропатией (синдром Фишера) в результате повреждений в периферической нервной системе. Записи ЭМГ и мигательных рефлексов целесообразны. при документировании клинически скрытых поражений ствола мозга, при множественном склерозе, а также при локализованных компрессионных поражениях на самых ранних стадиях в области тройничного и лицевого нервов вследствие небольших опухолей в задней черепной ямке.
Гистопатология мышцы и нерва
Биопсия мышцы позволяет: 1) отдифференцировать нейрогенный патологический процесс от миопатического; 2) идентифицировать такие специфические мышечные поражения, как мышечная дистрофия или врожденные миопатии; 3) идентифицировать специфические обменные поражения мышц (с применением гистохимических и биохимических методов); 4) диагностировать заболевания соединительной ткани и кровеносных сосудов (например, узелковый периартериит) и инфекционные болезни (например, трихинеллез или токсоплазмоз).
Осуществляют биопсию под местной анестезией. У детей и у взрослых, отягощенных какими-нибудь хроническими заболеваниями, достаточное количество материала для биопсии мышцы может быть получено при пункционной биопсии. При диагностике локализованных, местных патологических процессов (например, миозит или васкулит) может оказаться необходимой открытая биопсия. Во всех случаях мышца, выбранная для биопсии, должна адекватно отражать наличие патологического процесса в ней, а исследовать биоптат необходимо в соответствующей лаборатории. Нецелесообразно проводить биопсию мышцы, только что травмированной электромиографической иглой или перенесшей какое-либо иное болезненное состояние (например, сдавление спинномозгового корешка), поскольку может быть получена недостоверная информация, затрудняющая диагностику.
Гистология нормальной мышцы. На поперечном срезе нормальной мышцы видно большое количество мышечных волокон, сгруппированных в пучки соединительнотканными перегородками (перимизиум), по которым проходят нервные пучки и кровеносные сосуды. Отдельные мышечные волокна заключены в тонкий коллагеновый футляр (эндомизиум), на котором расположена сеть капилляров. Диаметр мышечных волокон в мышцах конечностей взрослого человека составляет 40—80 мкм. Каждое мышечное волокно состоит из миофибрилл, которые погружены в цитоплазму, с расположенными в ней митохондриями и саркоплазматической сетью и содержащую гликоген. Мышечное волокно окружено плазмолеммой (сарколемма) и базальной пластинкой. Мышечные волокна многоядерные (каждое из них по сути представляет собой синцитий), но почти все они оттеснены в субсарколеммиую область. Между базальной пластинкой и плазмолеммой мышечного волокна расположено несколько стволовых клеток или клеток-сателлитов; они являются основным источником миобластов, необходимых для регенерации поврежденных мышечных волокон. Гистохимическое деление мышечных волокон на I и II типы описано выше.
Следует отметить, что число патологических реакций мышцы на повреждение довольно ограниченное.
Денервация, ре иннервация. Денервированное мышечное волокно атрофируется, причем в начальных стадиях миофибриллы исчезают в большей степени, чем саркоплазма, содержащая митохондрии, так что гистологически мышечные волокна выглядят «очень темными» и окрашиваются на окислительные ферменты (рис. 354-4). Денервированные волокна, сжимаемые окружающими нормальными волокнами, становятся изломанными и атрофичными. В начальных стадиях денервации благодаря феномену наложения многих моторных единиц в одной и той же области атрофированные волокна расположены беспорядочно по всей мышце. Сохранившиеся моторные аксоны начинают давать отростки для реиннервации атрофированных мышечных волокон, в конечном итоге образуя группировки волокон по их типам (см. рис. 354-2, в). После отмирания этих увеличенных моторных единиц развивается атрофия волокон по группам (I и II типа). В хронически денервированной и реиннервируемой мышце распределение мышечных волокон в зависимости от диаметра происходит следующим образом: атрофичные денервированные волокна составляют одну популяцию, а иннервированные, нормальные волокна (или гипертрофированные) — другую. В случае феномена мышечной денервации-реиннервации, как правило, бывает трудно установить специфический (нозологический) диагноз или определить специфическую этиологию поражения только на основании данных мышечной биопсии.
Некроз мышечных волокон и их регенерация. Повреждение сарколеммы мышечного волокна способствует проникновению кальция в высокой, экстрацеллюлярной концентрации в среду саркоплазмы с низким содержанием этого иона. Поступление кальция вызывает активизацию нейтральной протеазы, что и начинает процесс протеолиза. Кальций подавляет митохондриальные функции и вызывает гибель митохондрий, приводя тем самым к смерти клетки. Проникающие в этот участок макрофаги фагоцитируют мышечные волокна. Клетки-сателлиты, которые обеспечивают основу для регенерации мышечных волокон, также участвуют практически во всех процессах, сопровождающихся повреждением мышцы. Так, они пролиферируют и «растворяются» для того, чтобы образовать многоклеточные мышечные трубочки, что способствует регенерации мышечных волокон. Регенерирующие мышечные волокна небольшого размера, базофильные благодаря повышенной концентрации РНК, в них заключены крупные везикулярные внутренние ядра. Распределение диаметра мышечных волокон при типичной хронической миопатии характеризуется однотипностью и широтой, что существенно отличается от бимодального распределения этих диаметров в случае денервации-реиннервации мышцы.
Некроз мышечных волокон и их регенерация — это обычная ответная реакция мышцы на повреждение, включая травму, дистрофию Дюшенна, полимиозит и дерматомиозит. В конечном итоге, если некроз протекает хронически, регенерация может «ослабеть», что приведет к прогрессирующей потере мышечных волокон и замене их жировой и соединительной тканью. Гистологические изменения в мышцах при хронической миопатии и при дистрофии Дюшенна показаны на рис. 354-5. Различия в распространенности скорости протекания указанных процессов позволяют гистологически дифференцировать мышечные дистрофии, воспалительные миопатии и острый рабдомиолиз.
Структурные изменения в мышечных волокнах. Дегенерация мышечных волокон без выраженного некроза вызывает структурные изменения в отдельных мышечных волокнах. Возникает дезорганизация миофибрилл, а саркоплазма образует «мишеневидные» волокна (см. рис. 354-4), появляются кольцевидные перетяжки (как будто часть одного мышечного волокна обнаруживается вокруг другого), центральные «стволики» из некротизированной ткани, тельца в виде клеток и немалиновые тельца. Иногда мышечные волокна напоминают «мышечные трубочки» (центронуклеарная миопатия). Изменения в митохондриях свидетельствуют о нарушениях биохимических процессов в них, а наличие вакуолей позволяет предположить возможность нарушения обмена гликогена или липидов. Очень четко очерченные вакуоли (скопление дегенерирующих фосфолипидов между миофибриллами) наиболее характерны для окулофарингеальной мышечной дистрофии и миозита с вирусными включениями.
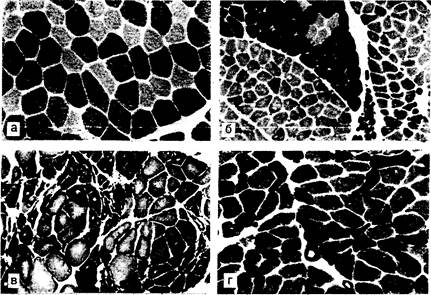
Рис. 354-4. Типичная гистологическая картина денервированной и реиннервированной мышцы. а — биоптат нормальной скелетной мышцы, окрашенный на миозин-АТФазу (рН 9,4).
Волокна I типа выглядят светлыми, II типа — темными; б — хронический процесс деиннервации-реиннервации, видна группировка волокон по типам (миозин-АТФаза, рН 9,4); в — процесс хронической деиннервации-реиннервации при боковом амиотрофическом склерозе (окраска на митохондриальный энзим NADH-TR). Видны группы рсиннервированных волокон II типа (светлые) и деформированных денервированных атрофических волокон, многие из них «сверхтемные» или «мишеневидные» (светлый центр и темные края); г — атрофия мышечных волокон II типа (окраска миозин-АТФаза, рН 9,4).
Воспалительные изменения. Для полиомиозита и дерматомиозита типична периваскулярная и интерстициальная воспалительная клеточная инфильтрация из лимфоцитов. Происходят также некроз и регенерация мышечных волокон. Иногда на периферии мышечного пучка можно обнаружить атрофию мышечных волокон (перифасцикулярная атрофия), которая бывает достаточно резко выражена и служит индикатором воспалительной миопатии даже в том случае, когда в биоптате мышцы не найдено фокуса воспаления. У больных с коллагенозами в мышечном биоптате выявляют васкулит, а при саркоидозе — гранулемы.
Изменения мышечных волокон, специфичные для определенного типа волокон. Патологическим изменениям могут подвергаться лишь волокна какого-либо одного гистологического типа. Так, чаще всего встречается атрофия мышечных волокон II типа (см. рис. 354-4), которая характерна для многих заболеваний, ограничивающих подвижность больного. Она возникает при длительном бездействии определенных мышц, при мышечной и суставной болях и при верхней моторной нейрональной дисфункции. Атрофия мышечных волокон I типа встречается гораздо реже — при миотонической дистрофии, ревматоидном артрите и при некоторых врожденных миопатиях.
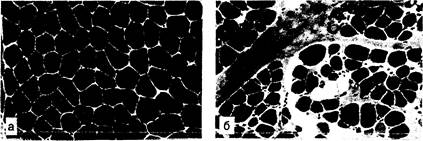
Рис. 354-5. Гистологические изменения в мышцах при дистрофии Дюшенна. а — нормальная мышца; б — мышечная дистрофия Дюшенна. Видны гипертрофия и атрофия мышечных волокон. Волокна дс иннервированы, число их уменьшено, заметен фиброз. Окраска гематоксилином и эозином.
Биопсия нерва. Биопсия нерва — достаточно трудно осуществимая процедура — более травматична для больного. Она показана относительно редко и лишь при особых обстоятельствах (см. гл. 355). Для биопсии обычно выбирают икроножный нерв или поверхностный лучевой нерв в области запястья. Оба эти нерва являются чувствительными, так что при чисто моторных нейропатиях в них может быть не обнаружено никаких патологических изменений. Процедуру биопсии нерва выполняют под местной анестезией, беря кусочки нервной ткани для световой, электронной микроскопии и для разволокнения отдельных нервных волокон. Биопсию нерва осуществляют при: 1) дифференциации между сегментальной демиелинизацией и аксональной дегенерацией; 2) при идентификации воспалительных невропатий и 3) при установлении таких специфических диагнозов, как амилоидоз, саркоидоз, лепра и некоторые метаболические невропатии. Полноценное исследование биоптата может быть проведено лишь в специально оборудованной лаборатории, специализирующейся по заболеваниям периферических нервов. При биопсии нерва чаще сталкиваются с двумя основными патологическими процессами.
Световая микроскопия обычно малоинформативна, так как позволяет выявить лишь самую грубую патологию: васкулит, воспаление, гранулематозную инфильтрацию или скопление амилоида, потерю аксонов, их дегенерацию. Гораздо более информативны электронная микроскопия и исследование отдельных, разволокненных нервных волокон. При некоторых заболеваниях поражаются особые типы нервных волокон; большие миелинизированные волокна поражаются при атаксии Фридрейха, а немиелинизированные волокна — при семейном амилоидозе. Дополнительную информацию может предоставить количественная морфометрия (определение количества волокон и распределения их диаметра).
Сегментарная демиелинизация. При различных патологических состояниях может поражаться либо миелин, либо шванновские клетки, при этом происходит дегенерация миелиновой оболочки, а аксон остается неповрежденным. Процесс восстановления при сегментарной демиелинизации проходит стадию образования необычайно истонченной миелиновой оболочки, которая, однако, в конечном итоге достигает нормальной толщины. И все же даже после восстановления при исследовании отдельных разволокненных нервных волокон можно выявить укороченные или различной длины участки нервного волокна между соседними перехватами Ранвье. Если этот процесс прогрессирует, возникают образования, напоминающие «луковицы», с нервными волокнами, покрытыми тонким слоем миелина и располагающимися в центре концентрической пластинки избыточной цитоплазмы шванновской клетки.
Дегенерация аксона. Смерть тела нервной клетки или части (секции) аксона на любом уровне приводит к дегенерации дистальных частей аксона с вторичной дегенерацией миелиновой оболочки. Если же нервная клетка остается интактной, то проксимально начинается регенерация аксона с образованием своеобразных выростов. Эти нервные «отростки» («пучки») типичны для аксональной дегенеративной и регенеративной невропатий. Чаще всего дегенерация аксонов возникает при токсикозах, наследственных, травматических и ишемических заболеваниях. Для аутоиммунных воспалительных болезней и наследственной патологии характерна сегментарная демиелинизация; при аутоиммунных воспалительных болезнях встречается воспалительная клеточная инфильтрация. При сахарном диабете обнаруживают смешанное поражение — аксональную дегенерацию, сегментарную демиелинизацию наряду с васкулопатией (микроангиопатии). Некоторые специфические гистологические изменения могут указывать на предположительную этиологию невропатии. При иммунофлюоресцентном анализе обнаруживают отложения IgM на связанный с миелином гликопротеид миелина, характерные для IgM-гаммапатий. При амилоидной невропатии в нерве обнаруживают фибриллы (волокна) амилоида. При метахроматической лейкодистрофии и при адреномиелолейкодистрофии в шванновских клетках находят специфические включения.
Дата добавления: 2015-03-17; просмотров: 1123;
