КИНЕТИКА МАССОПЕРЕДАЧИ
Массопередача — процесс перехода вещества (или нескольких веществ) из одной фазы в другую в направлении достижения равновесия.
В массообмене участвуют, как минимум, три вещества: распределяющее вещество (или вещества), составляющее первую фазу; распределяющее вещество (или вещества), составляющее вторую фазу; распределяемое вещество (или вещества), которое переходит из одной фазы в другую.
Обозначим первую фазу 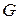 , вторую -
, вторую - 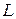 , а распределяемое вещество — М. Все массообменные процессы обратимы, поэтому распределяемое вещество может переходить из фазы
, а распределяемое вещество — М. Все массообменные процессы обратимы, поэтому распределяемое вещество может переходить из фазы 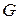 в фазу
в фазу 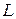 и наоборот в зависимости от концентрации вещества в фазах.
и наоборот в зависимости от концентрации вещества в фазах.
Пусть распределяемое вещество находится первоначально только в фазе 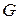 и имеет концентрацию
и имеет концентрацию 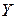 . В фазе
. В фазе 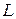 в начальный момент распределяемое вещество отсутствует, т. е. концентрация его в этой фазе
в начальный момент распределяемое вещество отсутствует, т. е. концентрация его в этой фазе 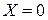 .
.
Если распределяющие фазы привести в соприкосновение друг с другом, начинается переход распределяемого вещества из фазы 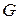 в фазу
в фазу 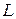 и с появлением вещества М в фазе
и с появлением вещества М в фазе 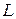 начинается обратный переход его из фазы
начинается обратный переход его из фазы 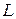 в фазу
в фазу 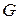 . До некоторого момента времени число частиц распределяемого вещества М, переходящих в единицу времени из фазы
. До некоторого момента времени число частиц распределяемого вещества М, переходящих в единицу времени из фазы 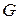 в фазу
в фазу 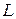 , больше, чем число частиц, переходящих из фазы
, больше, чем число частиц, переходящих из фазы 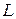 в фазу
в фазу 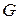 . Однако конечным результатом является переход вещества М из фазы
. Однако конечным результатом является переход вещества М из фазы 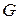 в фазу
в фазу 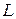 . По истечении определенного времени скорости прямого и обратного перехода вещества М в фазах
. По истечении определенного времени скорости прямого и обратного перехода вещества М в фазах 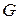 и
и 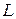 становятся одинаковыми. Такое состояние системы называется равновесным. При равновесии устанавливается строго определенная зависимость между концентрациями распределяемого вещества в фазах. Такие концентрации называют равновесными.
становятся одинаковыми. Такое состояние системы называется равновесным. При равновесии устанавливается строго определенная зависимость между концентрациями распределяемого вещества в фазах. Такие концентрации называют равновесными.
При равновесии каждой концентрации 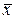 соответствует равновесная концентрация
соответствует равновесная концентрация 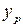 , и наоборот, каждой концентрации
, и наоборот, каждой концентрации 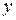 соответствует определенная равновесная концентрация
соответствует определенная равновесная концентрация 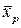 .
.
В условиях равновесия существуют определенные в каждом конкретном случае зависимости между концентрациями:
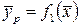 ;
; 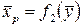 . (12.1)
. (12.1)
Эти зависимости определяются экспериментально и называются равновесными зависимостями.
Равновесные зависимости изображаются графически кривой или в частном случае прямой линией. На рис. 12.1 показана зависимость равновесной концентрации у компонента в газовой фазе 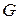 от его концентрации
от его концентрации 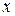 в жидкой фазе
в жидкой фазе 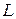 при постоянных давлении и температуре.
при постоянных давлении и температуре.

Рис. 12.1 Диаграмма равновесия при p=const и t=const
Отношение концентраций компонента в фазах в условиях равновесия 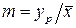 называется коэффициентом распределения.
называется коэффициентом распределения.
Коэффициент распределения геометрически выражает тангенс угла наклона линии равновесия. В случае кривой линии равновесия коэффициент распределения является переменной величиной.
Конкретный вид законов равновесия применительно к различным процессам массопередачи будет рассматриваться в соответствующих главах.
Равновесные зависимости позволяют определить не только направление процесса, но и скорость перехода распределяемого вещества из одной фазы в другую.
Разность между фактической и равновесной концентрациями, характеризующая степень недостижения равновесия, является движущей силой массообменных процессов.
Расчет движущих сил и коэффициентов скорости массообменных процессов составляет кинетику массопередачи.
Основные уравнения массопередачи могут быть получены из общего уравнения кинетики. Согласно этому уравнению скорость массообменных процессов прямо пропорциональна движущей силе процесса и обратно пропорциональна диффузионному (массообменному) сопротивлению.
Обозначив величину, обратную диффузионному сопротивлению, через  (где
(где  - диффузионное, или массообменное, сопротивление), запишем
- диффузионное, или массообменное, сопротивление), запишем
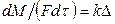 , (12.2)
, (12.2)
где: М – количество вещества, перешедшего из одной фазы в другую; F – площадь поверхности массопередачи; τ – продолжительность процесса; k – коэффициент скорости процесса, называемый в теории массопередачи; Δ – движущая сила.
Нетрудно видеть, что 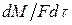 является скоростью массопередачи, отнесенной к единице контакта фаз.
является скоростью массопередачи, отнесенной к единице контакта фаз.
Если 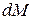 отнесено к единице времени, имеем
отнесено к единице времени, имеем
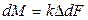 . (12.3)
. (12.3)
При 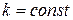 для всей поверхности массообмена
для всей поверхности массообмена
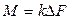 . (12.4)
. (12.4)
Уравнения (12.3) и (12.4) называют основными уравнениями массопередачи. Согласно этим уравнениям количество вещества, перенесенного из ядра одной фазы в ядро другой фазы, пропорционально разности его концентраций в ядрах фаз, площади поверхности фазового контакта и продолжительности процесса.
Коэффициент массопередачи показывает, какое количество вещества переходит из одной фазы в другую в единицу времени через единицу поверхности фазового контакта при движущей силе, равной единице.
Коэффициенты массопередачи в зависимости от единиц, в которых выражены движущая сила и количество распределяемого вещества, могут выражаться в м/с, кг/(ед. дв. силы 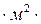 с), кмоль/ (ед. дв. силы
с), кмоль/ (ед. дв. силы 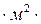 с).
с).
Дата добавления: 2015-03-14; просмотров: 1579;
