Структури кристалів. Структурні мотиви
Тип хімічного зв’язку визначає взаємне розташування атомів у кристалічній структурі. Оскільки зв'язки переважно електростатичні, то кожен іон прагне зібрати навколо себе (координувати) іони протилежного знаку. Найбільш сильні зв'язки сполучають іон з його найближчими сусідами. Кількість таких найближчих сусідів називається координаційним числом. Розглядаючи іони як дотичні сфери, легко зрозуміти, що координаційне число залежить від розмірів координованих іонів, що виражаються відношенням радіуса катіона до радіуса аніона Rk:Ra (рис.10).
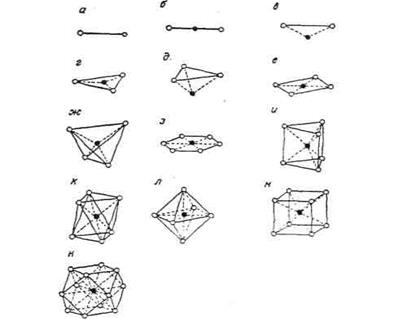
Рис. 10. Основні координаційні багатогранники і багатокутники із відповідними координаційними числами
Якщо це відношення близьке до одиниці, то іони розташовуються в структурі відповідно до законів щільної упаковки: гексагональної (2х-шарової) або кубічної (3х-шарової). У інших випадках геометрія розташування атомів у структурі буде складнішою. В цьому випадку геометричний характер структури найпростіше описати за допомогою структурних мотивів:
· 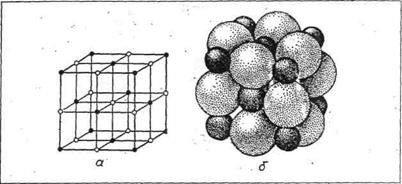 координаційний– атоми розподілені рівномірно, не утворюючи ніяких кінцевих або нескінченних угрупувань (рис.11). Це структури гомодесмічні (NaCl, алмаз, метали);
координаційний– атоми розподілені рівномірно, не утворюючи ніяких кінцевих або нескінченних угрупувань (рис.11). Це структури гомодесмічні (NaCl, алмаз, метали);
Рис. 11. Приклад координаційного типу структури галіту:
а – упаковка з точок-центрів іонів Na+ і Cl-; б – упаковка з куль
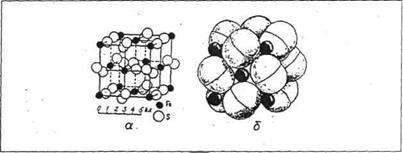
· острівний – атоми зібрані в окремі кінцеві угрупування, усередині яких зв'язки сильніші (відстані між атомами мало), а між цими групами зв'язку слабкі (відстань між ними збільшується). Це структури гетеродесмічні. Острівні структурні угрупування можуть бути валентно-насиченими (сірка), катіонними і аніонними (карбонати) (рис. 12). В останньому випадку зв'язок усередині угрупування, а зв'язок між катіоном і аніонним угрупуванням - іонний;
|
Рис. 12. Приклад острівного типу структури піриту:
а – упаковка з точок-центрів іонів Fe2+ і S2-; б – упаковка з куль
· стрічковий – ковалентно-зв'язані угрупування атомів, з'єднуючись між собою (полімеризуючись), можуть утворювати нескінченні витягнуті в одному напрямі нейтральні або валентно-ненасичені аніонні ланцюги, зв'язок між якими може бути залишковим (Ван-дер-Ваальсовим), водневим або через катіони. Такий структурний мотив спостерігається у багатьох силікатах (рис.13);
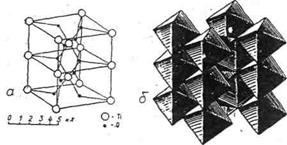 Рис.13. Приклад стрічкового типу структури рутилу:
Рис.13. Приклад стрічкового типу структури рутилу:
а – упаковка точок-центрів іонів; б – упаковка з поліедрів
· шаруватий – нескінченні орієнтовані в одній площині валентно-нейтральні пакети із міцно зв'язаних атомів одного (графіт) або інших матеріалів (гідроксиди) поділені на шари, зв'язок між якими залишковий (Ван-дер-Ваальсовий) або водневий (рис.14);
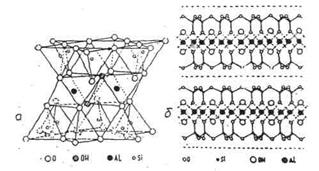
Рис.14. Приклад шаруватого типу структури тальку-пірофініту:
а – об’ємне зображення; б – поперечна проекція
· каркасний – тривимірний зв'язок із атомних угрупувань, сполучених вершинами, усередині якої є великі порожнечі. На відміну від координаційних структур атоми розподілені у просторі нерівномірно, навіть якщо каркас нейтральний (кварц) і між атомами переважає один тип зв'язку (рис.15).
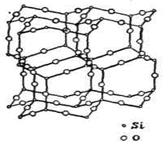
Рис. 15. Приклад каркасного типу структури β-тридиміту
Реальний склад і структура реальних мінеральних індивідів відрізняються від ідеальних, виражених у хімічних формулах і структурних схемах. Ці відхилення, пов'язані із коливаннями, прийнято розглядати в рамках існуючих теоретичних понять про поліморфізм та ізоморфізм.
Поліморфізм– перетворення структури хімічної сполуки без зміни її хімічного складу, під впливом зовнішніх умов (T, Р, рН).
Мінерали одного і того ж складу, але різної структури – поліморфні модифікації (від лат. "полі" – багато, "морфо" – форма) – належать до різних мінеральних видів. Кожна модифікація стійка при визначених термодинамічних параметрах. Зі зміною умов відбувається перехід однієї модифікації в іншу. Розрізняють переходи двох видів: оборотні – енантіотропні (різні модифікації SiO2: кварц - кристобаліт) і необоротні – монотропні (модифікації С: графіт - алмаз).
Якщо такий перехід здійснюється зі збереженням форми кристалів первинного мінералу, то утворюються псевдоморфози. Одним з різновидів поліморфізму є політипія – зрушення або поворот ідентичних двовимірних шарів, що приводить до утворення структурних різновидів.
Ізоморфізм (від лат. "ізо" – однаковий, рівний, "морфос" – вигляд, образ) – зміна хімічного складу мінералу при збереженні його кристалічної структури. Варіації складу є в даному випадку результатом заміщення в даній структурі одного іона або іонного угрупування на інший іон або групу іонів. Необхідною умовою таких заміщень є близькість хімічних властивостей і розмірів тих, що заміщають один одного атомів.
Є декілька видів ізоморфізму:
· Ізовалентний – атоми, що заміщають один одного, мають однакову валентність. Як приклад таких заміщень – заміщення Мg+2 на Fe+2 в, коли існують усі проміжні склади мінералу від фаяліта (Mg2SiO4) до форстериту (Fe2SiO4). Прикладом повного аніонного ряду ізовалентних ізоморфних заміщень між двома з'єднаннями є KCl і KBr;
· Гетеровалентний ізоморфізм - однією із найважливіших умов його появи є вимога збереження електронейтральності структури. Вона може бути виконана в результаті парного заміщення, коли в одній сполуці один з іонів (наприклад, Ca2+) заміщається на іон з меншою валентністю (такий, як Na1+) і, в той же час, інший іон (наприклад, Al3+) заміщається на іон з більшою валентністю (такий, як Si4+). Сумарний заряд при цьому зберігається, що можна виразити у вигляді рівності:
Ca2+ + Al3+ = Na+ + Si4+.
Такий тип заміщень відомий у ряді плагіоклазів.
Дата добавления: 2015-03-14; просмотров: 1431;
