Электронные спектры поглощения.
Спектральные исследования являются одним из главных источников информации о строении атомов и молекул, их оптических свойствах и взаимодействии с окружающей средой. Так, верхней энергетической границей колебательного спектра обычно считают энергию фотонов примерно в 5000 см-1, или около 60 кДж/моль. Дальнейшее увеличение энергии облучающих квантов чаще всего будет приводить к возбуждению электронов и появлению в спектре полос, характеризующих электронные переходы. Спектры поглощения в видимой и ультрафиолетовой областях обусловлены переходами атомов или молекул из основного состояния в возбуждённое. Одновременно с электронной изменяются колебательная и вращательная энергии, которые на несколько порядков меньше энергии электронного возбуждения. Таким образом, один электронный переход даёт большое число линий в спектре за счёт различного рода колебательных и вращательных переходов. Так, частоту спектральной линии в таком спектре в общем случае можно представить как сумму трёх слагаемых:
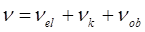
Для данного электронного перехода 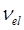 будет являться постоянной, а сумма:
будет являться постоянной, а сумма:
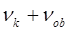
переменная, которая может быть вычислена на основании уравнения вида:
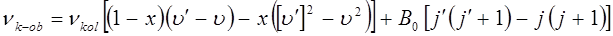
при этом вся вращательно-колебательная структура спектра будет смещена с инфракрасной, в видимую или ультрафиолетовую (УФ) области электромагнитного спектра. Поскольку вращательный терм по сравнению с колебательным является достаточно малым, то общее представление о спектре можно получить, изучая только колебательную структуру электронного спектра двухатомной молекулы.
При этом, с каждой полосы электронно-колебательно-вращательного спектра рассматривают только те спектральные линии, для которых вращательное квантовое число 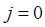 при данном электронном переходе. Тогда энергия жёсткой молекулы будет определяться уравнением вида:
при данном электронном переходе. Тогда энергия жёсткой молекулы будет определяться уравнением вида:
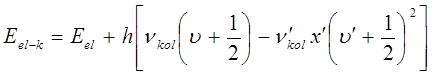
а частота нулевой линии в спектре:
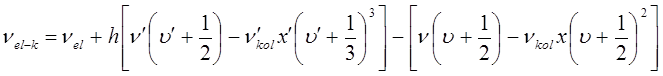
Аналогичная эмпирическая формула для нулевой линии электронно-колебательного спектра двухатомной молекулы в своё время была получена Деландром:
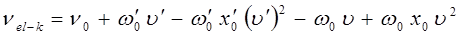
В данном уравнении величины 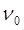 ,
, 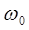 ,
, 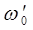 ,
, 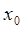 и
и 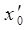 представляют эмпирические постоянные, значения которых можно вычислить на основании уравнений вида:
представляют эмпирические постоянные, значения которых можно вычислить на основании уравнений вида:
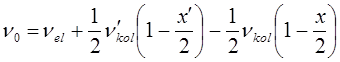
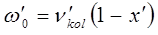
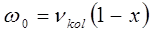
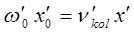
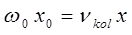
В действительности каждый электронный переход в молекуле приводит к образованию в молекулярном спектре системы полос, нулевые линии которых описываются формулой Деландра, получая аналогичную картину как и в случае вращательно-колебательного спектра, однако вся система полос смещена с инфракрасной области спектра в видимую или ультрафиолетовую.
Необходимо отметить, что изучение электронных спектров поглощения позволяет получить важные сведения об электронном строении и различных свойствах атомов и молекул. Так, при поглощении света, атом или молекула переходит из основного состояния с энергией 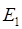 в возбуждённое состояние, с энергией
в возбуждённое состояние, с энергией 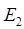 . Частота поглощаемого излучения связана с разностью энергий
. Частота поглощаемого излучения связана с разностью энергий 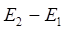 и может быть найдена на основании соотношения вида:
и может быть найдена на основании соотношения вида:
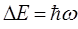
поскольку:
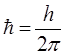
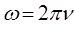
будем иметь соответственно:
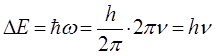
учитывая, что:
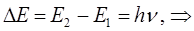
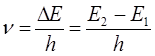
а также:
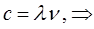
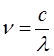
принимая во внимание, что связь между длиной волны 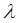 и волновыми числами
и волновыми числами 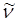 :
:
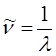
нетрудно установить связь частот 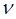 , длин волн
, длин волн 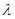 и волновых чисел
и волновых чисел 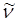 .
.
Так, как было установлено выше:
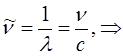
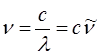
или после подстановки в выражение вида:
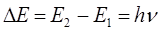
будем иметь соответственно:
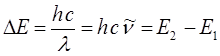
Величина 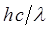 (или
(или 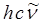 ) представляет собой энергию света с длиной волны
) представляет собой энергию света с длиной волны 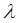 , поглощаемую одной молекулой. Умножая её на число Авогадро
, поглощаемую одной молекулой. Умножая её на число Авогадро 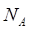 , получаем количество энергии, пересчитанное на 1 моль вещества. Длину волны
, получаем количество энергии, пересчитанное на 1 моль вещества. Длину волны 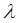 в видимой или УФ – спектроскопии обычно выражают либо в ангстремах (Å), либо в нанометрах (нм). Волновые числа выражают обычно в обратных сантиметрах (см-1).
в видимой или УФ – спектроскопии обычно выражают либо в ангстремах (Å), либо в нанометрах (нм). Волновые числа выражают обычно в обратных сантиметрах (см-1).
Волновое число 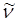 равно количеству волн, приходящихся на 1 см; чем больше длина волны, тем меньшее количество волн укладывается на длине в 1 см, т.е. тем меньше волновое число. Взаимосвязь между длиной волны, частотой и волновым числом может быть установлена на основании соотношения вида:
равно количеству волн, приходящихся на 1 см; чем больше длина волны, тем меньшее количество волн укладывается на длине в 1 см, т.е. тем меньше волновое число. Взаимосвязь между длиной волны, частотой и волновым числом может быть установлена на основании соотношения вида:
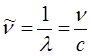
Так, например, когда волна сталкивается с молекулой, она может либо рассеиваться, либо поглощаться, передаваясь молекуле. Относительная вероятность протекания того или иного процесса является свойством той молекулы, с которой произошло столкновение. Если произошло поглощение электромагнитной энергии света, о молекуле говорят, что она возбуждена или перешла в возбужденное состояние. Молекула или часть молекулы, которая может быть возбуждена посредством поглощения света в видимой и ближней УФ – области, называется хромофором.
УФ – область является коротковолновой областью спектра, с одной стороны примыкающей к видимой её части, а с другой переходящей на рентгеновский спектр. Весь УФ – спектр делят на ближний, с длиной волны 400-300 нм, который примыкает к видимой (400-800 нм), дальней (300-200 нм) и вакуумной (200-50 нм) УФ – областям. Предметом изучения абсорбционной – спектроскопии является изучение электронных спектров поглощения. Так, поглощение энергии происходит с наибольшей вероятностью только в том случае, если количество поглощённой энергии соответствует разности энергий в соответствующих квантованных состояниях, в которых может находиться рассматриваемая система:
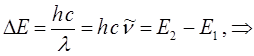
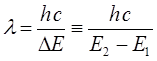
Таким образом, свет с длиной волны l поглощается только тогда, когда:
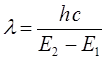
здесь 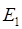 - энергетический уровень атома или молекулы до поглощения, а
- энергетический уровень атома или молекулы до поглощения, а 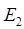 - энергетический уровень, достигаемый в результате поглощения. Упрощённо, переход между электронными энергетическими уровнями соответствует энергии, необходимой для перемещения электрона с одной молекулярной орбитали на другую. Зависимость вероятности поглощения от длины волны называется спектром поглощения. Задача абсорбционной спектроскопии состоит в накоплении и анализе данных по спектрам поглощения. Таким образом, поглощение световой энергии в видимой и УФ – областях, связаны с различным типом электронных переходов. Оптические спектры атомов связаны с квантовыми переходами электронов внешней электронной оболочки. При объединении атомов в молекулу обобществлённые (валентные) электроны образуют внешнюю оболочку и остаются ответственными за оптические спектры. Как показали расчёты, при образовании молекул, имеет место расщепление энергетических уровней. При этом образуются молекулярные орбитали трёх типов – связывающие, разрыхляющие и несвязывающие. Объяснение этому можно дать только с позиций метода молекулярных орбиталей, который позволяет наиболее корректно показать суть данного явления. Так, с точки зрения метода молекулярных орбиталей, молекула рассматривается как единая система ядер и электронов. Волновая функция такой системы будет задаваться как линейная комбинация соответствующих атомных орбиталей. Такой подход получил название метода линейных комбинаций атомных орбиталей (ЛКАО – МО). С позиций данного метода, для образования устойчивой молекулярной орбитали необходимо, чтобы энергии исходных атомных орбиталей были близки друг к другу. При этом последние не должны сильно отличаться по свойствам симметрии. Орбитальные коэффициенты, входящие в выражение полученной таким образом молекулярной волновой функции, будут очевидно определять вклад каждой из комбинируемых базисных волновых функций в образование молекулярной орбитали. Так, если указанные выше условия образования молекулярной орбитали соблюдены, т.е. если исходные атомные волновые функции близки по энергии и свойствам симметрии, тогда для случая, например двухатомных молекул, орбитальные коэффициенты
- энергетический уровень, достигаемый в результате поглощения. Упрощённо, переход между электронными энергетическими уровнями соответствует энергии, необходимой для перемещения электрона с одной молекулярной орбитали на другую. Зависимость вероятности поглощения от длины волны называется спектром поглощения. Задача абсорбционной спектроскопии состоит в накоплении и анализе данных по спектрам поглощения. Таким образом, поглощение световой энергии в видимой и УФ – областях, связаны с различным типом электронных переходов. Оптические спектры атомов связаны с квантовыми переходами электронов внешней электронной оболочки. При объединении атомов в молекулу обобществлённые (валентные) электроны образуют внешнюю оболочку и остаются ответственными за оптические спектры. Как показали расчёты, при образовании молекул, имеет место расщепление энергетических уровней. При этом образуются молекулярные орбитали трёх типов – связывающие, разрыхляющие и несвязывающие. Объяснение этому можно дать только с позиций метода молекулярных орбиталей, который позволяет наиболее корректно показать суть данного явления. Так, с точки зрения метода молекулярных орбиталей, молекула рассматривается как единая система ядер и электронов. Волновая функция такой системы будет задаваться как линейная комбинация соответствующих атомных орбиталей. Такой подход получил название метода линейных комбинаций атомных орбиталей (ЛКАО – МО). С позиций данного метода, для образования устойчивой молекулярной орбитали необходимо, чтобы энергии исходных атомных орбиталей были близки друг к другу. При этом последние не должны сильно отличаться по свойствам симметрии. Орбитальные коэффициенты, входящие в выражение полученной таким образом молекулярной волновой функции, будут очевидно определять вклад каждой из комбинируемых базисных волновых функций в образование молекулярной орбитали. Так, если указанные выше условия образования молекулярной орбитали соблюдены, т.е. если исходные атомные волновые функции близки по энергии и свойствам симметрии, тогда для случая, например двухатомных молекул, орбитальные коэффициенты 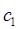 и
и 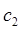 должны быть близкими по своим значениям, что и обеспечивает максимальное перекрывание электронных облаков. Итак, если при сложении соответствующих исходных (базисных) атомных орбиталей образуется молекулярная орбиталь энергия которой понижается относительно энергий атомных орбиталей, то такая молекулярная орбиталь называется связывающей. Волновая функция, соответствующая связывающей орбитали, получается в результате сложения волновых функций с одинаковым знаком. Электронная плотность при этом концентрируется между ядрами и волновая функция принимает положительное значение. При вычитании атомных орбиталей, энергия молекулярной орбитали повышается. Эта орбиталь называется разрыхляющей. Электронная плотность в этом случае располагается за ядрами, а между ними равна нулю. Волновая функция в двух образовавшихся электронных облаках имеет противоположные знаки. Когда атомная орбиталь одного из атомов вследствие большой разницы в энергии или симметрии не может взаимодействовать с атомной орбиталью другого атома, она переходит в энергетическую схему молекулярных орбиталей молекулы с энергией, соответствующей ей в атоме. Орбиталь этого типа называется несвязывающей. Разделение молекулярных орбиталей на
должны быть близкими по своим значениям, что и обеспечивает максимальное перекрывание электронных облаков. Итак, если при сложении соответствующих исходных (базисных) атомных орбиталей образуется молекулярная орбиталь энергия которой понижается относительно энергий атомных орбиталей, то такая молекулярная орбиталь называется связывающей. Волновая функция, соответствующая связывающей орбитали, получается в результате сложения волновых функций с одинаковым знаком. Электронная плотность при этом концентрируется между ядрами и волновая функция принимает положительное значение. При вычитании атомных орбиталей, энергия молекулярной орбитали повышается. Эта орбиталь называется разрыхляющей. Электронная плотность в этом случае располагается за ядрами, а между ними равна нулю. Волновая функция в двух образовавшихся электронных облаках имеет противоположные знаки. Когда атомная орбиталь одного из атомов вследствие большой разницы в энергии или симметрии не может взаимодействовать с атомной орбиталью другого атома, она переходит в энергетическую схему молекулярных орбиталей молекулы с энергией, соответствующей ей в атоме. Орбиталь этого типа называется несвязывающей. Разделение молекулярных орбиталей на 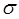 -,
-, 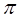 - и
- и 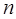 - типы производится в соответствии с симметрией их электронных облаков аналогично
- типы производится в соответствии с симметрией их электронных облаков аналогично 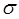 - и
- и 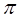 - связям в методе валентных связей.
- связям в методе валентных связей. 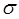 - орбиталь имеет такую симметрию электронного облака, при которой поворот её вокруг оси, соединяющей ядра, на 180° приводит к орбитали, по форме не отличимой от первоначальной. Знак волновой функции при этом не меняется. В случае же
- орбиталь имеет такую симметрию электронного облака, при которой поворот её вокруг оси, соединяющей ядра, на 180° приводит к орбитали, по форме не отличимой от первоначальной. Знак волновой функции при этом не меняется. В случае же 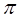 - орбитали при повороте её на 180° знак волновой функции меняется на противоположный. Отсюда следует, что
- орбитали при повороте её на 180° знак волновой функции меняется на противоположный. Отсюда следует, что 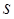 - орбитали атомов при взаимодействии между собой могут образовывать только
- орбитали атомов при взаимодействии между собой могут образовывать только 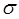 - орбитали, соответственно
- орбитали, соответственно 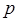 - орбитали – одну
- орбитали – одну 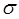 - и две
- и две 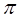 - орбитали, причём
- орбитали, причём 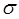 - орбиталь возникает при взаимодействии
- орбиталь возникает при взаимодействии 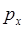 атомных орбиталей, а
атомных орбиталей, а 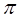 - орбиталь – при взаимодействии
- орбиталь – при взаимодействии 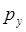 - и
- и 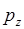 - орбиталей. Молекулярные
- орбиталей. Молекулярные 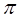 - орбитали повёрнуты относительно межъядерной оси на 90°, в чём прослеживается полная аналогия данного метода с методом валентных связей.
- орбитали повёрнуты относительно межъядерной оси на 90°, в чём прослеживается полная аналогия данного метода с методом валентных связей.
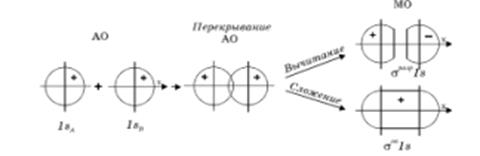
Рис. 5. Схема образования связывающей и разрыхляющей молекулярных орбиталей.
Так, в ходе решения уравнения Шрёдингера в рамках вариационной задачи Релея – Ритца для молекулярных систем, получают решения, отвечающие молекулярным орбиталям трёх типов – связывающие, разрыхляющие и несвязывающие. При этом в зависимости от типа комбинируемых атомных орбиталей, различают молекулярные орбитали 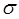 - и
- и 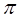 - типа. Орбитали обоих типов могут быть как связывающими, так и разрыхляющими. Поглощение света сопровождается переходом электронов со связывающей
- типа. Орбитали обоих типов могут быть как связывающими, так и разрыхляющими. Поглощение света сопровождается переходом электронов со связывающей 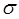 - или
- или 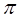 - орбитали на разрыхляющую
- орбитали на разрыхляющую 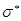 или
или 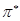 - орбитали. В связи с этим различают
- орбитали. В связи с этим различают 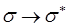 и
и 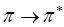 переходы. Не участвующие в образовании химических связей электроны неподелённых электронных пар образуют несвязывающие
переходы. Не участвующие в образовании химических связей электроны неподелённых электронных пар образуют несвязывающие 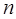 - орбитали. Энергия неподелённой пары электронов в молекуле равна её энергии в изолированном атоме.
- орбитали. Энергия неподелённой пары электронов в молекуле равна её энергии в изолированном атоме.
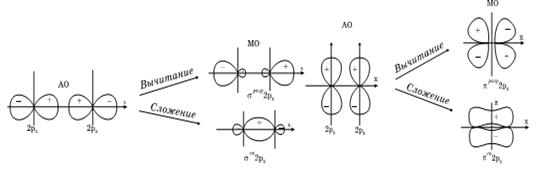
Рис. 6. Схема образования 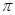 - связывающих и
- связывающих и 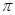 - разрыхляющих молекулярных орбиталей.
- разрыхляющих молекулярных орбиталей.
Несвязываюшие 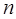 - орбитали локализованы на отдельных атомах, тогда, как
- орбитали локализованы на отдельных атомах, тогда, как 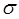 - и
- и 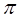 - орбитали обычно распространяются на два или более атома в молекуле. Как видно из приведенной выше схемы, уровень несвязывающей молекулярной орбитали
- орбитали обычно распространяются на два или более атома в молекуле. Как видно из приведенной выше схемы, уровень несвязывающей молекулярной орбитали 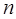 расположен выше уровней связывающих
расположен выше уровней связывающих 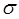 - и
- и 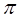 - орбиталей. В основном состоянии
- орбиталей. В основном состоянии 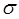 -,
-, 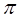 - и
- и 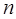 - орбитали обычно заняты электронами, а
- орбитали обычно заняты электронами, а 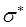 - и
- и 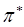 - орбитали свободны. Поглощение света происходит в результате переходов с занятых орбиталей на свободные. Наибольшей энергии, очевидно, будет требовать
- орбитали свободны. Поглощение света происходит в результате переходов с занятых орбиталей на свободные. Наибольшей энергии, очевидно, будет требовать 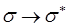 переход, характерный для насыщенных молекул и соответствующих поглощению в вакуумном УФ (l<200 нм). Переходы
переход, характерный для насыщенных молекул и соответствующих поглощению в вакуумном УФ (l<200 нм). Переходы 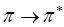 типа происходят в молекулах с сопряжёнными связями и в ароматических молекулах. Они связаны с поглощением квантов энергии соответственно в видимой или ближней УФ – областях спектра. Переходы
типа происходят в молекулах с сопряжёнными связями и в ароматических молекулах. Они связаны с поглощением квантов энергии соответственно в видимой или ближней УФ – областях спектра. Переходы 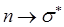 и
и 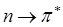 обычно происходят в молекулах, содержащих гетероатомы. Хромофоры – это функциональные группы, которые поглощают электромагнитное излучение независимо от того, возникает при этом окраска или нет. Они содержат группировки атомов, содержащие
обычно происходят в молекулах, содержащих гетероатомы. Хромофоры – это функциональные группы, которые поглощают электромагнитное излучение независимо от того, возникает при этом окраска или нет. Они содержат группировки атомов, содержащие 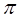 - электроны или свободные электронные пары гетероатомов, которые дают свои, характеристические линии поглощения в УФ – области спектра.
- электроны или свободные электронные пары гетероатомов, которые дают свои, характеристические линии поглощения в УФ – области спектра.
Ауксохромы – это функциональные группы, например, 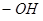 ,
, 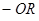 ,
, 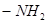 и другие, которые, вступая в сопряжение с хромофором за счёт своих неподелённых электронов, становятся частью нового, более протяжённого хромофора.
и другие, которые, вступая в сопряжение с хромофором за счёт своих неподелённых электронов, становятся частью нового, более протяжённого хромофора.

Рис. 7. Типы электронных переходов.
Изменение свойств электронной оболочки в результате электронного перехода приводит к изменению потенциальной энергии системы, поэтому кривая потенциальной энергии молекул в разных электронных состояниях не будет одинакова. В возбуждённом состоянии обычно происходит увеличение равновесного межъядерного расстояния, уменьшение энергии диссоциации и изменение других свойств по сравнению со свойствами в основном состоянии. Существенное значение в электронной спектроскопии имеет принцип Франка - Кондона. При взаимодействии молекулы с квантом света электронная оболочка столь быстро переходит в возбуждённое состояние, что положение ядер измениться не успевает. Таким образом, за время перехода молекулы в возбуждённое состояние межъядерное расстояние меняться не будет. Однако в новом электронном состоянии равновесное межъядерное расстояние обычно отличается от того, которым обладала молекула в своём основном состоянии, и колебательные уровни возбуждённого состояния также будут другими.
Таблица 3. Типичные хромофоры и их характеристики.
| Хромофор | Длина волны, нм | Коэффициент молярной экстинкции (eмах) и интенсивность полосы поглощения | Возбуждение |
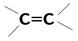
| 14 000 сильная 8 000 сильная | p-электронов | |
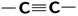
| 10 000 сильная 2 000 сильная 150 слабая | p-электронов | |
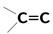
| 18 000 сильная 5 000 сильная 15 слабая | p-электронов Свободной электронной пары кислорода | |
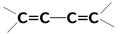
| 20 000 сильная | p-p* | |
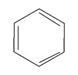
| 60 000 сильная 4 400 средняя 204 слабая | p-p* n-p* | |

| Полоса средней силы | Свободной электронной пары кислорода | |
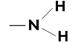
| Полоса средней силы | Свободной электронной пары азота |
Так как наиболее вероятны переходы без изменения межъядерного расстояния, им и будут отвечать наиболее интенсивные полосы в спектрах поглощения. Использование принципа Франка-Кондона в спектроскопии многоатомных молекул также приводит к важным результатам, позволяя решить вопрос о типе колебаний и структуре молекул. В случае многоатомных молекул картина становится значительно более сложной, так как потенциальная энергия многоатомных молекул может быть представлена уже не просто кривой, а поверхностью потенциальной энергии в n-мерном пространстве. В некоторых случаях на интенсивность и положение полосы поглощения влияют природа растворителя или окружение хромофора, причём в результате полоса может сдвигаться как в длинноволновую, так и в коротковолновую область. Согласно старой номенклатуре, могут иметь место следующие эффекты:
1. Батохромный сдвиг (или красный сдвиг) – в сторону длинных волн. Такой сдвиг могут вызывать, например, алкильные группы, расположенные по соседству с хромофором;
2. Гипсохромный сдвиг (или синий сдвиг) – в сторону коротких волн;
3.Гиперхромный эффект – повышение интенсивности поглощения;
4. Гипохромный эффект – понижение интенсивности поглощения.
Применение УФ – спектроскопии, например, для идентификации и анализа молекул органических соединений ограничено соединениями, содержащими хромофорные группы. Характеристические линии поглощения многих ароматических (бензол, нафталин) и гетероароматических соединений (пиридин, хинолин) зависят от протяжённости и расположения 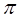 -электронной системы. Это позволяет распознавать различные соединения одного и того же ряда. Метод УФ – спектроскопии используют также для определения содержания в соединениях различных примесей следов веществ, дающих характеристические линии поглощения в исследуемой области УФ – спектра.
-электронной системы. Это позволяет распознавать различные соединения одного и того же ряда. Метод УФ – спектроскопии используют также для определения содержания в соединениях различных примесей следов веществ, дающих характеристические линии поглощения в исследуемой области УФ – спектра.
Интенсивность полос в спектре поглощения характеризуют интегралом поглощения, или силой осциллятора, определяемой выражением:
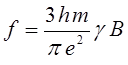
где B - коэффициент Эйнштейна, характеризующий вероятность перехода. Коэффициент Эйнштейна связан с электрическим дипольным моментом перехода и некоторыми другими величинами. Он может быть также рассчитан из экспериментальных данных на основании уравнения:
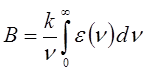
где K - объединяет несколько величин, а интеграл вида:
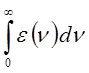
называют интегралом поглощения. Сочетание уравнений:
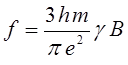
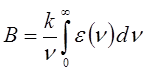
и подстановка числовых значений фундаментальных констант приводят к выражению:
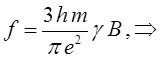
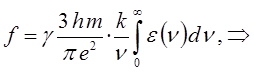
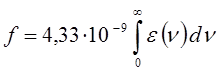
Соотношение вида:
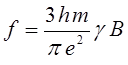
показывает, что чем более вероятным является переход, тем больше сила осциллятора. Так, разрешённые переходы характеризуются величиной 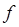 , близкой к единице, как наблюдается у интенсивно окрашенных красителей, а у запрещённых переходов, например у переходов с изменением мультиплетности терма, сила осциллятора составляет примерно 10-7. Для аналитической характеристики соединений имеет значение не столько интегральное поглощение, сколько светопоглощение при определённой длине волны. Важными аналитическими характеристиками являются молярный коэффициент поглощения в точке максимума
, близкой к единице, как наблюдается у интенсивно окрашенных красителей, а у запрещённых переходов, например у переходов с изменением мультиплетности терма, сила осциллятора составляет примерно 10-7. Для аналитической характеристики соединений имеет значение не столько интегральное поглощение, сколько светопоглощение при определённой длине волны. Важными аналитическими характеристиками являются молярный коэффициент поглощения в точке максимума 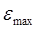 и полуширина полосы поглощения
и полуширина полосы поглощения 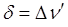 . Наибольшей интенсивностью в спектрах поглощения обладают полосы, обусловленные переносом электрона от данного атома к другому (полосы переноса заряда). Часто эти полосы связаны с переносом электрона с
. Наибольшей интенсивностью в спектрах поглощения обладают полосы, обусловленные переносом электрона от данного атома к другому (полосы переноса заряда). Часто эти полосы связаны с переносом электрона с 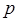 -орбитали лиганда на
-орбитали лиганда на 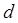 -орбиталь центрального иона и наоборот. Более правильно следует говорить о переносе электрона между молекулярными орбиталями, локализованными у разных атомов. Интенсивные полосы в спектре, появившиеся в результате такого рода переходов, имеют молярный коэффициент поглощения порядка 104 и более. К ним относятся многие
-орбиталь центрального иона и наоборот. Более правильно следует говорить о переносе электрона между молекулярными орбиталями, локализованными у разных атомов. Интенсивные полосы в спектре, появившиеся в результате такого рода переходов, имеют молярный коэффициент поглощения порядка 104 и более. К ним относятся многие 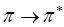 и
и 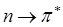 - переходы. Переносом заряда объясняют, например, интенсивную окраску ионов
- переходы. Переносом заряда объясняют, например, интенсивную окраску ионов 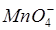 ,
, 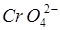 , окраску тиоцианатных комплексов железа, кобальта, молибдена, сульфосалицилатных комплексов, фенантролиновых комплексов и многих других. Значительно менее интенсивные полосы, связанные с внутриатомными
, окраску тиоцианатных комплексов железа, кобальта, молибдена, сульфосалицилатных комплексов, фенантролиновых комплексов и многих других. Значительно менее интенсивные полосы, связанные с внутриатомными 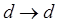 и
и 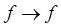 - переходами. Это, вообще говоря, запрещённые переходы (
- переходами. Это, вообще говоря, запрещённые переходы ( 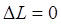 ) дают полосы с молярным коэффициентом поглощения от 1 до величин, редко превышающих 100. Снятие запрета с
) дают полосы с молярным коэффициентом поглощения от 1 до величин, редко превышающих 100. Снятие запрета с 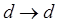 - переходов в комплексах чаще всего объясняют частичным смешиванием
- переходов в комплексах чаще всего объясняют частичным смешиванием 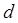 - и
- и 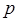 -орбиталей и переходом электрона уже со смешанных
-орбиталей и переходом электрона уже со смешанных 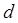 - и
- и 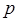 -орбиталей на
-орбиталей на 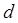 -орбитали, что не запрещено. Успешно интерпретирует спектры
-орбитали, что не запрещено. Успешно интерпретирует спектры 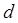 - и
- и 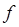 -элементов теория кристаллического поля. Спектры окрашенных соединений в растворе обычно характеризуются довольно широкими полосами поглощения. Уширение полос связано с сильным влиянием молекул растворителя на энергетические уровни электронов, ответственных за светопоглощение, и наложением колебательных переходов на электронный переход. Почти всегда очень широкие полосы наблюдаются в спектрах переноса заряда. Ионы лантаноидов имеют узкие полосы поглощения, так как их внутренние
-элементов теория кристаллического поля. Спектры окрашенных соединений в растворе обычно характеризуются довольно широкими полосами поглощения. Уширение полос связано с сильным влиянием молекул растворителя на энергетические уровни электронов, ответственных за светопоглощение, и наложением колебательных переходов на электронный переход. Почти всегда очень широкие полосы наблюдаются в спектрах переноса заряда. Ионы лантаноидов имеют узкие полосы поглощения, так как их внутренние 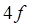 -электроны, ответственные за светопоглощение, экранированы внешними
-электроны, ответственные за светопоглощение, экранированы внешними 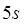 - и
- и 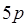 -электронами. Очевидно, чем выше молярный коэффициент поглощения и меньше ширина полосы, тем более ценными химико-аналитическими свойствами обладает соединение, так как эти характеристики полосы определяют такие важные показатели, как предел обнаружения и селективность.
-электронами. Очевидно, чем выше молярный коэффициент поглощения и меньше ширина полосы, тем более ценными химико-аналитическими свойствами обладает соединение, так как эти характеристики полосы определяют такие важные показатели, как предел обнаружения и селективность.
Дата добавления: 2015-03-14; просмотров: 6881;
