ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ.
4.1.Одержання нітробензену.
4.1.1 Хід роботи: в суху пробірку поміщають 2 краплі концентрованої нітратної кислоти і 3 краплі концентрованої сульфатної кислоти. Одержану нітруючу суміш охолоджують і додають 2 краплі бензену. Пробірку поміщають у водяну баню, яка нагріта до 50-55°С, на 2-3 хв, постійно збовтують вміст пробірки . Після цього виливають реакційну суміш в приготовлену пробірку з водою.
4.1.2 Спостереження:на дно опускається крапля жовтуватого нітробензену.
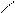 NO2
NO2

 4.1.3 Хімізм реакцій:+ НО – NO2 → + Н2О
4.1.3 Хімізм реакцій:+ НО – NO2 → + Н2О
НО – NO2 + 2H2SO4 = NO2+ + 2HSO4- + [H3O]+
4.1.4 Висновок: швидкість реакції нітрування залежить від об’єму нітрування і складу нітруючої суміші.
4.2.Одержання динітробензену.
4.2.1 Хід роботи: в пробірку поміщають 2 краплі HNO3 і 3 краплі H2SO4 . До гарячої нітруючої суміші додають 2 краплі нітробензену і нагрівають на водяній бані, яка кипить, при постійному збовтуванні 3-4 хв. Потім реакційну суміш охолоджують і виливають в пробірку з водою. Для одержання мононітробензену потрібно температуру 50°С, а для одержання динітробензену - 90°С.
4.2.2 Спостереження: динітробензен спочатку виділяється у вигляді тяжкої маслянистої краплі, потім швидко переходить в кристалічний стан.
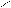
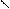

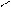
 NO2 NO2 NO2
NO2 NO2 NO2
4.2.3 Хімізм реакцій: +HO – NO2 → + H2O
4.2.4 Висновок: нітрогрупа відноситься до замісників ІІ роду.
4.3. Нітрування фенолу.
4.3.1.Хід роботи:в пробірку поміщають декілька кристалів фенолу, 2-3 краплі води і мішають до утворення однорідного розчину. В круглу пробірку поміщають 3 краплі НNО3 (конц.) і 3 краплі води. Розбавлену НNО3 краплинами додають до рідкого фенолу, весь час взбовтуючи і охолоджуючи реакційну пробірку. Потім реакційну суміш виливають в пробірку з декількома краплями води. Отвір пробірки закривають корком з газовідвідною трубкою і відганяють о-нітрофенол в чисту, суху пробірку-приймач.
4.3.2. Спостереження: мутний розчин має гіркий запах.
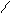 OH
OH


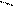
 ОН NO2
ОН NO2
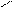 4.3.3. Хімізм реакцій: +НО – NO2 – + H2O
4.3.3. Хімізм реакцій: +НО – NO2 – + H2O
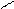

 OH
OH

NO2
4.3.4.Висновок: реакції заміщення фенолів проходять значно легше, ніж у ароматичних вуглеводнів.
4.4. Одержання метиламіну з ацетаміду.
4.4.1. Хід роботи:в пробірку з газовідвідною трубкою помістити на кінчику мікролопатки ацетамід, 4 краплі води і 2 краплі брому. Вміст пробірки обережно збовтати, охолодити водою і доливати по краплині концентрований розчин лугу до знебарвлення брому.
Потім добавити таку ж кількість крапель 1н розчину лугу. Вміст пробірки нагрівати в полум’ї пальника, занурити кінець газовідвідної трубки в пробірку з водою, що охолоджується льодом.
4.4.2. Спостереження:відгін має характерний для метиламіну запах сирої риби і аміаку.
4.4.3. Хімізм реакцій:
 O O
O O

 СН3 – С + Вr2 + NaOH → CH3 – C + NaBr + H2O
СН3 – С + Вr2 + NaOH → CH3 – C + NaBr + H2O
NH2 NHBr
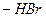
 O
O
 CH3 – C → CH3 – N = C = O
CH3 – C → CH3 – N = C = O
NHBr
CH3 – N = C = O + H2O → CH3 – NH2 + CO2
4.4.4. Висновок: розпад амідів протікає через декілька стадій.
4.5. Властивості амінів жирного ряду.
4.5.1. Хід роботи:перевірка водного розчину на індикатори:
а) До отвору газовідвідної трубки приладу для отримання метиламіну піднести вологий червоний лакмусовий папірець.
б) В пробірку поміщаємо 2 краплі водного розчину метиламіну і добавити 1 краплю розчину фенолфталеїну.
4.5.2. Спостереження: рожевий колір та характерний запах.
 4.5.3. Хімізм реакцій:
4.5.3. Хімізм реакцій:
СН3NH2 + HOH D [CH3NH3]+OH- D [CH3NH3]+ + OH-
 H Cl H
H Cl H
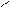
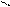
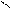 CH3 – N + C → CH3 – N = C + 3HCl
CH3 – N + C → CH3 – N = C + 3HCl
H Cl Cl
CH3 – N = C + HCl + 2H2O → [CH3NH3]+ Cl- + HCOOH
4.5.4. Висновок: ця реакція є специфічною для первинних амінів.
4.6. Реакція з розчином купрум (ІІ) сульфату.
4.6.1. Хід роботи: в пробірку помістити 2 краплі розчину метиламіну, добавити 2 краплі купрум (ІІ) сульфату – випадає голубий осад. До реакційної суміші добавити по краплях надлишок розчину аміну. Осад розчиняється, розчин набуває інтенсивного фіолетового забарвлення.
4.6.2. Спостереження: випадає голубий осад, потім осад розчиняється, розчин забарвлюється в фіолетовий колір.
4.6.3. Хімізм реакцій:
2[СН3NH3]ОН + СuSO4→ [СН3NH3 ]2 SO4 + Сu(ОН)2
4.6.4. Висновок: метиламін осаджує купрум (ІІ) гідроксид.
4.7. Реакція з розчином ферум (ІIІ) хлориду.
4.7.1. Хід роботи: в пробірку ввести 2-3 краплі розчину метиламіну і добавити декілька крапель розчину ферум (ІІІ)хлориду.
4.7.2. Спостереження: випадає осад Fe(OH)3.
4.7.3.Хімізм реакцій:
3[CH3NH3]OH + FeCl3 → 3[CH3NH3]Cl + Fe(OH)3↓
4.7.4. Висновок: аміни є органічними основами.
4.8. Реакція газоподібного метиламіну з концентрованою хлоридною кислотою.
4.8.1. Хід роботи: до отвору газовідвідної трубки приладу для отримання метиламіну підносимо скляну паличку змочену концентрованою хлоридною кислотою.
4.8.2. Спостереження: утворюється білий осад.
4.8.3. Хімізм реакцій: СН3NH2 + HCl → [CH3NH3]Cl↓
4.8.4. Висновок: аміни як похідні аміаку проявляють основні властивості.
4.9.Розчинність аніліну у воді.
4.9.1. Хід роботи:в пробірку поміщаємо 5 крапель води , 1 краплю аніліну і енергійно збовтуємо.
4.9.2. Спостереження: анілін погано розчиняється у воді.
4.9.3. Хімізм реакцій:
4.9.4. Висновок: Aнілін погано розчиняється у воді.
4.10.Утворення солі аніліну.
4.10.1. Хід роботи: до розчину з попереднього досліду додаємо по краплях концентровану хлоридну кислоту.
4.10.2. Спостереження: утворився прозорий розчин.
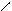
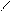 NH2 NH3
NH2 NH3


 4.10.3. Хімізм реакцій: +НСl → [ ]+ Cl-
4.10.3. Хімізм реакцій: +НСl → [ ]+ Cl-
4.10.4. Висновок: анілін утворює солі тільки з сильними мінеральними кислотами.
4.11. Кольорова реакція аніліну з хлоридним вапном.
4.11.1. Хід роботи:до 1 мл розчину хлориднокислого аніліну добавляємо 1 краплю хлоридного вапна.
4.11.2. Спостереження:з ’являється темно-зелене забарвлення.
4.11.3. Хімізм реакцій:
4.11.4. Висновок: анілін легко окислюється.
4.12. Бромування аніліну.
4.12.1. Хід роботи:в пробірку поміщаємо 3 краплі бромної води і 1 краплю анілінової води.
4.12.2. Спостереження: випадає білий осад.
4.12.3. Хімізм реакцій:
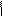 NH2 NH2
NH2 NH2

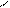

 Br Br
Br Br
+ 3Br2 → + 3НВr
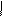

Br
4.12.4. Висновок:бромування аніліну проходить легко.
4.13. Діазотування сульфанілової кислоти.
4.13.1. Хід роботи:в першу пробірку поміщаємо на кінці мікролопатки сульфанілову кислоту, 4 краплі розчину їдкого натру і легенько нагріваємо, потім приливаємо 0,5н розчин натрію нітриту. В другу пробірку поміщаємо кусочок льоду, обережно доливаємо 2 краплі сульфатної кислоти і виливаємо в першу пробірку. Залишити на наступний дослід.
4.13.2. Спостереження: випадає білий осад діазобензолсульфо кислоти.

 4.13.3. Хімізм реакцій:
4.13.3. Хімізм реакцій:
НО3S – – NH2 + NaOH → NaO3S – – NH2 + H2O

 NaО3S – – NH2 + NaNO2 + H2SO4 → O3S – – N2 + Na2SO4 + 2H2O
NaО3S – – NH2 + NaNO2 + H2SO4 → O3S – – N2 + Na2SO4 + 2H2O
4.13.4. Висновок: діазотувати можна будь яку ароматичну сполуку, що містить первинну аміногрупу в ароматичному ядрі.
4.14.Одержання геліантину.
4.14.1. Хід роботи: в першій пробірці знаходиться розчин діазосульфанілової кислоти з попереднього досліду. В другій пробірці змішують 3 краплі диметиланіліну і 5 крапель льодяної оцтової кислоти до одержання однорідного розчину. До розчину додають шматочок льоду і при помішуванні додають суміш діазобензенсульфокислоти (з попереднього досліду). потім додають декілька крапель розчин їдкого натру до лужної реакції на лакмус . Виділяється оранжевий осад натрієвої солі геліантину (метилоранжу).
4.14.2. Спостереження: виділяється оранжевий осад.
4.14.3. Хімізм реакцій:



 НО3S NaO3S +H2SO4 + NaNO2 O3S NaOH NaO3S
НО3S NaO3S +H2SO4 + NaNO2 O3S NaOH NaO3S





 + NaОН → + →
+ NaОН → + →



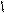 -Н2О -Nа2SO4 – 2H2O
-Н2О -Nа2SO4 – 2H2O
 | |||
 |
NH2 NH2 N2 N(CH3)2 N = N

 4.14.4. Висновок:ми одержали геліантин.
4.14.4. Висновок:ми одержали геліантин.
N(CH)3
4.15. Властивості геліантину.
4.15.1. Хід роботи:у пробірку поміщають 2 краплі геліантину і 10 крапель води. Вміст пробірки ретельно перемішують і ділять на 2 пробірки: в одну додають 2 краплі кислоти, в другу - 2 краплі лугу.
4.15.2. Спостереження:в пробірці з кислотою з’являється червоний колір, а в пробірці з лугом – жовтий.
4.15.3. Хімізм реакцій: 


 NaSO3 N = N N(CH3)2 + HCl →
NaSO3 N = N N(CH3)2 + HCl →
[ NaSO3 NH – N = = N(CH3)2]+ Cl-
4.15.4. Висновок:геліантин – добрий індикатор.
КОНТРОЛЬНІ ЗАПИТАННЯ:
1. Навести приклади різних нітросполук .
2. З бензену добути пікринову кислоту, м- нітробензойну кислоту.
3. Порівняйте умови нітрування бензену, толуену і бензенсульфокислоти.
4. При відновленні 61,5 г нітробензену одержано 44 г аніліну. Розрахувати вихід аніліну у % до теоретично можливого виходу.
5. Навести приклади реакцій амінування, умови проведення.
6. Здійснити синтези:
а) з СН2 = СН2 à анілін
б) з СН2 =СН2 à сульфанілову кислоту
в) з С6Н6 à 2,4,6–триброманілін.
8. Який об’єм аніліну (ρ = 1,02 г/см3) можна одержати із нітробензену масою 9,2 г.
9. Яку масу нітробензену треба взяти, щоб відновленням одержати анілін масою 186 г, вихід якого складає 92% від теоретичного.
10. Опишіть хімічні властивості діазосполук на прикладі о-толілдіазоній хлориду.
11.З бензену добудьте:
а) о-нітробензендіазоний хлорид;
б) м-нітробензендіазоній гідроксид;
в).метилоранж.
ЛІТЕРАТУРА:
А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980. Досліди 136, 137, 62.
А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980.Досліди 139, 140 (1,3,4,5), 142, 143, 144 (2), 145.
А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980. Гл.10, Досліди 153, 155.
Дата добавления: 2014-12-08; просмотров: 1485;
