ЛАБОРАТОРНА РОБОТА № 5.
1. Тема: Гідроксильні сполуки і їх похідні. Феноли.
2. Мета:Вивчити властивості фенолів.
3. МАТЕРІАЛИ І ОБЛАДНАННЯ:
3.1 Фенол кристалічний, їдкий натр (2н розчин), натрію фенолят.
3.2 Хлоридна кислота (2н розчин), феруму (ІІІ) хлорид (0,1н розчин).
3.3 Бромна вода, Н2SO4 ( r = 1,84 г/см3 ), НNO3 ( r = 1,4 г/см3 ).
3.4 1%-ий розчин пірокатехіну, резорцину, гідрохінону, пірогалолу.
3.5 Їдкий натр (концентрований розчин).
3.6 Велика пробірка, газовідвідна трубка.
4. ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ:
4.1 Розчинення фенолу у воді.
4.1.1 Хід роботи:помістити у пробірку 2 краплі рідкого фенолу, добавити 2 краплі води і збовтати. Дати суміші відстоятися. Пізніше суміш у пробірці розшаровується: верхній шар - розчин фенолу у воді, нижній - розчин води у фенолі. Обережно нагріти пробірку над пальником.
4.1.2 Спостереження: утворюється мутна рідина – емульсія
фенолу.
4.1.3 Хімізм реакцій:
4.1.4 Висновок: фенол погано розчиняється у холодній воді.
4.2 Одержання натрію феноляту.
4.2.1 Хід роботи:в пробірку поміщають 4 краплі емульсії фенолу у воді і добавляють 2 краплі розчину їдкого натрію. Швидко збовтують.
4.2.2. Спостереження: утворюється безбарвний розчин.
4.2.3 Хімізм реакцій: С6Н5 – ОН + NaOH → C6H5 – ONa + H2O
4.2.4 Висновок: феноли володіють кислотними властивостями.
4.3 Розклад натрію феноляту хлоридною кислотою.
4.3.1. Хід роботи:в пробірку поміщаємо 4 краплі емульсії фенолу у воді, добавляють 2 краплі розчину їдкого натру і краплю розчину хлоридної кислоти.
4.3.2. Спостереження:виділяється вільний фенол у вигляді емульсії.
4.3.3. Хімізм реакцій: С6Н5 – ONa + HCl → C6H5 – OH + NaCl
4.3.4. Висновок: розчини фенолятів лужних металів володіють лужною реакцією.
4.4. Реакція фенолу з ферум (ІІІ) хлоридом.
4.4.1. Хід роботи:в пробірку помістити 2 краплі розчину фенолу, добавити 3 краплі води і 1 краплю розчину ферум (ІІІ)хлориду.
4.4.2. Спостереження:з’являється червоно-фіолетове забарвлення
4.4.3. Хімізм реакцій:С6Н5ОН + FeCl3 → C6H5OFeCl2 + HCl
4.4.4. Висновок:феноли з ферум (ІІІ)хлоридом дають кольорову реакцію.
4.5. Одержання трибромфенолу.
4.5.1. Хід роботи:в пробірку вводять 2 краплі бромної води і добавляють краплю водного розчину фенолу.
4.5.2. 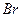 Спостереження: розчин знебарвлюється, випадає білий осад.
Спостереження: розчин знебарвлюється, випадає білий осад.
 | |||
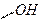 | |||
4.5.3. 
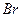
 Хімізм реакцій: + 3Br2 → +3HBr
Хімізм реакцій: + 3Br2 → +3HBr
4.5.4. Висновок:гідроксильна група відноситься до найбільш сильних орто-пара-орієнтантів.
4.6. Нітрування фенолу.
4.6.1. Хід роботи: в пробірку поміщають декілька кристалів фенолу, 2-3 краплі води і мішають до утворення однорідного розчину. В другу пробірку поміщають 3 краплі НNО3 (конц.) і 3 краплі води. Розбавлену НNО3 по краплях переливають до рідкого фенолу, весь час збовтуючи і охолоджуючи реакційну пробірку. Потім реакційну суміш виливають в пробірку з декількома краплями води. Отвір пробірки закривають корком з газовідвідною трубкою і відганяють о-нітрофенол в чисту, суху пробірку-приймач.
4.6.2. Спостереження: о-нітрофенол має характерний мигдальний запах.
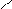 NO2
NO2
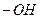
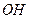



 →
→
4.6.3. Хімізм реакцій: +Н NO3 →
 NO2 + Н2О
NO2 + Н2О

 →
→
 |
ОН
4.6.4. Висновок: Гідроксильна група активує ядро, що її містить.
4.7. Кольорові реакції багатоатомних фенолів з ферум (ІІІ) хлоридом.
4.7.1. Хід роботи:в одну пробірку вносять 3 краплі розчину пірокатехіну, в другу - 3 краплі розчину резорцину, в третю - 3 краплі розчину гідрохінону, в четверту - 3 краплі розчину пірогалолу. В кожну з пробірок добавляють по одній краплі розчину ферум (ІІІ) хлориду.
4.7.2. Спостереження: в першій пробірці з’являється зелене забарвлення, в другій – фіолетове, в третій - зелене, що переходить в жовте, в четвертій – червоне.
4.7.3. Хімізм реакцій:
4.7.4. Висновок: одночасно з утворенням фенолятів ферум (ІІІ) хлорид діє на фенол і як окисник.
4.8. Окислення пірогалолу киснем повітря.
4.8.1. Хід роботи:в пробірку поміщають на кінці мікролопатки пірогалол, добавляють 3-4 краплі концентрованого розчину лугу, потім закривають пробірку корком з газовідвідною трубкою, другий кінець якої занурений до дна в пробірку з 6-8 краплями підфарбованої води. Збовтують пробірку з пірогалолом і лугом.
4.8.2. Спостереження:суміш чорніє.
4.8.3 Хімізм реакцій:
4.8.4 Висновок: окислення пірогалолу в лужному середовищі відбувається дуже енергійно.
КОНТРОЛЬНІ ЗАПИТАННЯ:
1. Хімічні властивості фенолів.
2. З бензену добути фенол різними методами.
3. Скільки фенолу можна одержати із 1 т хлорбензену шляхом гідролізу при нагріванні, якщо вихід фенолу складає 15% від теоретичного?
4. З бензену добути о-нітрофенол і м-нітрофенол.
5. Які застережливі заходи при роботі з фенолом?
Література:
А.В. Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: «ВШ». 1980. Гл. 5. Досл. 56, 57, 58, 59, 60, 62, 63, 67.
Дата добавления: 2014-12-08; просмотров: 1954;
