ЛАБОРАТОРНА РОБОТА № 6
1. ТЕМА:Карбонові кислоти.
2. МЕТА: Вивчити властивості одноосновних та двоосновних карбонових кислот.
3. МАТЕРІАЛИ І ОБЛАДНАННЯ:
3.1 Кислоти: мурашина, стеаринова, олеїнова, щавлева, оцтова (0,1 н розчини).
3.2 Магній; натрію карбонат (кр.); баритова вода.
3.3 Метил оранжевий розчин; лакмус синій розчин, фенолфталеїн 1%-ий спиртовий розчин.
3.4 Натрію форміат; сульфатна кислота 2 н розчин.
3.5 Калію перманганат 1 н розчин; мурашина кислота безводна; сульфатна кислота концентрована.
3.6 Натрію ацетат кристалічний; кальцію хлорид 0,1 н розчин; феруму (ІІІ) хлорид 0,1 н розчин.
3.7 Дерев’яні скалки.
4. ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ:
4.1 Кислотні властивості карбонових кислот.
4.1.1. Хід роботи:
а):втри пробірки поміщають по 1 краплі розчину оцтової кислоти. В першу пробірку додають 1 краплю метил оранжевого розчину, в другу - 1 краплю лакмусу, в третю - 1 краплю фенолфталеїну.
б): В пробірку кладуть 2 краплі оцтової кислоти і добавляють трошки магнію. До отвору пробірки підносять палаючу скалку.
в): В пробірку наливають 2-3 краплі розчину оцтової кислоти і добавляють декілька крупинок натрію карбонату. До отвору пробірки підносять палаючу скалку.
4.1.2 Спостереження:
а)в пробірці з метил оранжевим розчином появляється червоне забарвлення, в пробірці з лакмусовим розчином – рожеве, в пробірці з фенолфталеїном - безбарвне.
б)спостерігаємо спалах, що супроводжується різким звуком, характерним для спалаху суміші водню і повітря.
в) скалка гасне тому, що виділяється вуглекислий газ.
4.1.3 Хімізм реакцій:
О 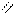
 б) 2СН3 – С + Мg → (СН3СООН)2Мg + Н2 ↑
б) 2СН3 – С + Мg → (СН3СООН)2Мg + Н2 ↑
Н
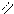 О О
О О
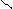
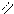
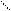 в) 2СН3 – С + Nа2СО3 → 2СН3 – С + СО2 + Н2О
в) 2СН3 – С + Nа2СО3 → 2СН3 – С + СО2 + Н2О
ОН ОNа
4.1.4 Висновок:
а) карбонові кислоти у водному розчині дисоціюють з утворенням карбоксилат-аніона і протона, це пояснює збільшення кислотності карбонових кислот в порівнянні з спиртами.
б) відбувається заміщення водню на магній, що характерно для кислот.
в) утворилась сіль карбонової кислоти.
4.2. Окислення мурашиної кислоти калію перманганатом.
4.2.1. Хід роботи:в пробірку кладуть декілька крупинок натрію форміату, добавляють 2 краплі розчину калію перманганату і 3 краплі розчину сульфатної кислоти. Отвір пробірки закривають корком з газовідвідною трубкою, кінець якої занурюють в пробірку з баритовою водою. Вміст пробірки нагрівають на полум’ї пальника.
4.2.2. Спостереження: рожевий розчин знебарвлюється, а баритова вода темніє (мутніє).
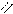
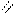 О O
О O
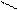 4.2.3. Хімізм реакцій: Н – С + Н2SO4 → H – C + NаНSO4
4.2.3. Хімізм реакцій: Н – С + Н2SO4 → H – C + NаНSO4
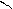 ONа OH
ONа OH
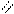
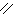 О О
О О
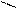
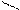 Н – С + [O] → [OH – C ] + Н2О + СО2
Н – С + [O] → [OH – C ] + Н2О + СО2
Н ОН
СО2 + Ва(ОН)2 → ВаСО3 + Н2О
4.2.4. Висновок: мурашина кислота на відміну від інших карбонових кислот легко окислюється.
4.3. Розклад мурашиної кислоти при нагріванні з концентрованою сульфатною кислотою.
4.3.1.Хід роботи: в пробірку наливають 3 краплі мурашиної кислоти, 3 краплі концентрованої сульфатної кислоти і нагрівають суміш на полум’ї пальника. Газ, що виділяється, підпалюємо.
4.3.2.Спостереження:виділений газ горить голубим полум’ям.
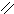 О Н2SО4
О Н2SО4
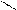 4.3.3.Хімізм реакцій: Н – С → СО↑ + Н2О
4.3.3.Хімізм реакцій: Н – С → СО↑ + Н2О
ОН
4.3.4.Висновок: мурашина кислота під дією концентрованої сульфатної кислоти розкладається з утворенням оксиду вуглецю (ІІ).
4.4.Одержання натрієвої солі щавлевої кислоти.
4.4.1.Хід роботи: В суху пробірку кладуть декілька крупинок мурашинокислого натрію і сильно нагрівають на полум’ї пальника. Розплавлена сіль розкладається з виділенням водню. Вміст пробірки охолоджують, додають до розплаву 3-4 краплі води і повільно нагрівають до появлення прозорого розчину.
В другу пробірку кладуть декілька крупинок мурашинокислого натрію і додають 3-4 краплі води. В обидві пробірки по одній краплі розчину хлориду кальцію.
4.4.2.Спостереження:в першій пробірці утворився осад кальцієвої солі щавлевої кислоти. В пробірці з розчином мурашино-кислого натрію осад не утворився, так як кальцієва сіль мурашиної кислоти розчиняється у воді.
 СООNа
СООNа
4.4.3.Хімізм реакцій: 2Н – СООNa → Н2 + СООNа
СООNа

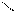 СОО
СОО

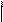 СООNа + СаСl2 → СОО Са + 2NаСl
СООNа + СаСl2 → СОО Са + 2NаСl
2Н – СООNa + CaCl2 → (H – COO)2Ca + 2NaCl
4.4.4.Висновок: щавлеву кислоту одержують швидким нагріванням форміату до 420°С.
4.5. Розкладання щавлевої кислоти при нагріванні.
4.5.1. Хід роботи:декілька кристалів щавлевої кислоти нагрівають в пробірці з газовідвідною трубкою, відтягнутий кінець якої опущений в пробірку з баритовою водою. Виділяється газ. Після цього газовідвідну трубку виймають з пробірки з баритовою водою і підпалюють газ, що виділяється.
4.5.2. Спостереження:газ спричиняє помутніння баритової води.
4.5.3. Хімізм реакцій:
СООН нагрів. СООН

 ·2Н2О → + 2Н2О
·2Н2О → + 2Н2О
СООН СООН
 СООН нагрів.
СООН нагрів.
→ СО2 + Н – СООН
СООН
4.5.4.Висновок: виділяється оксид вуглецю і мурашина кислота.
4.6. Розклад щавлевої кислоти при нагріванні з концентрованою сульфатною кислотою.
4.6.1.Хід роботи: в пробірку кладуть декілька кристалів щавлевої кислоти і додають 2 краплі сульфатної кислоти. Пробірку закривають корком з газовідвідною трубкою і нагрівають на полум’ї пальника. Газ, що виділяється, підпалюють. Після того кінець газовідвідної трубки опускають в баритову воду.
4.6.2.Спостереження: газ горить голубим полум’ям, а баритова вода мутніє.
4.6.3.Хімізм реакцій:
Н2SO4
НООС – СООН → СО + СО2 + Н2О
СО2 + Ва(ОН)2 → ВаСО3 + Н2О
4.6.4.Висновок: під дією концентрованої сульфатної кислоти щавлева кислота на відміну від інших двоосновних кислот розкладається.
4.7. Окислення щавлевої кислоти калію перманганатом.
4.7.1.Хід роботи: в пробірку кладуть декілька кристалів щавлевої кислоти, добавляють 2 краплі перманганату калію і 1 краплю сульфатної кислоти. Отвір пробірки закривають корком з газовідвідною трубкою, кінець якої опускають в пробірку з баритовою водою. Суміш нагрівають.
4.7.2.Спостереження: рожевий розчин перманганату калію знебарвлюється, а в пробірці з баритовою водою випадає білий осад карбонату.
4.7.3.Хімізм реакцій:НООС – СООН + [O] → 2СО2 + Н2О
4.7.4.Висновок:щавлева кислота володіє відновними властивостями.
4.8. Приєднання брому до олеїнової кислоти.
4.8.1.Хід роботи: в пробірку вносять 3-4 краплі бромної води, 1 краплю олеїнової кислоти і енергійно збовтують.
4.8.2.Спостереження: бромна вода знебарвлюється.
4.8.3.Хімізм реакцій: СН3 – (СН2)7 – СН = СН – (СН2)7 – СООН + Вr2 → CН3 - (СН2)7 – СНВr – СНВr - (СН2)7 – СООН
4.8.4.Висновок:олеїнова кислота вступає в реакції приєднання.
КОНТРОЛЬНІ ЗАПИТАННЯ:
1. Описати хімічні властивості карбонових кислот на прикладі оцтової кислоти.
2. З метану одержати мурашину, оцтову, пропіонову, щавлеву і ізомасляну кислоти.
3. Чому серед кислот немає газів?
4. На нейтралізацію 50 мл 0,1 М розчину кальцію гідроксиду пішло 150 мл розчину оцтової кислоти невідомої концентрації. Визначіть молярність розчину оцтової кислоти.
ЛІТЕРАТУРА:
А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980. Гл. 7. Досл. 92, 93, 96, 97, 98-103.
Дата добавления: 2014-12-08; просмотров: 2080;
