Одержання ацететилового естеру.
4.1.1. Хід роботи: в суху пробірку кладуть трошки зневодненого порошку натрію ацетату (висота шару 1 – 1,5 мм) і 3 краплі етилового спирту. Додають 2 краплі сульфатної кислоти і обережно нагрівають над полум’ям пальника.
4.1.2. Спостереження: з’являється характерний свіжий запах ацететилового естеру.
4.1.3. Хімізм реакцій:
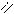
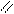 О O
О O
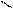
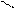 R – С + Н2SO4 → R – C + NaHSO4
R – С + Н2SO4 → R – C + NaHSO4
ONa OH

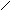
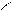 О Н+ О
О Н+ О
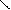
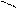 R – С + R’ – ОН D R – С + Н2О
R – С + R’ – ОН D R – С + Н2О
OН ОR
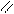
 О О
О О

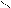 СН3 – С + С2Н5ОН D СН3 – С + Н2О
СН3 – С + С2Н5ОН D СН3 – С + Н2О
ОН ОС2Н5
4.1.4. Висновок: важливим способом отримання складних еcтерів є взаємодія карбонових кислот із спиртами, каталізатором є сульфатна кислота.
4.2. Взаємодія оцтового ангідриду з водою .
4.2.1. Хід роботи:в пробірку поміщають 5 крапель води, 2 краплі оцтового ангідриду і збовтують. Оцтовий ангідрид у воді не розчиняється. Обережно нагрівають вміст пробірки на полум’ї пальника.
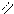 4.2.2. Спостереження: до нагрівання оцтовий ангідрид у воді не розчиняється, тому після відстоювання суміш розшаровується – оцтовий ангідрид утворює нижній шар, а після нагрівання рідина стає однорідною. О
4.2.2. Спостереження: до нагрівання оцтовий ангідрид у воді не розчиняється, тому після відстоювання суміш розшаровується – оцтовий ангідрид утворює нижній шар, а після нагрівання рідина стає однорідною. О
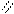
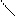 4.2.3.Хімізм реакцій:СН3 –С О
4.2.3.Хімізм реакцій:СН3 –С О
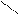
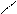 О + НОН → 2СН3 – С
О + НОН → 2СН3 – С
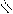 СН3 –С ОН
СН3 –С ОН
О
4.2.4. Висновок: ангідриди реагують з водою тільки при нагріванні.
4.3. Взаємодія оцтового ангідриду з лугом.
4.3.1. Хід роботи:поміщаємо в пробірку 5 крапель води, додаємо 2 краплі оцтового ангідриду і 2 краплі розчину їдкого натру. Енергійно збовтуємо.
4.3.2. Спостереження: утворився однорідний розчин.
4.3.3. Хімізм реакцій:
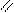 О
О
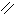
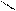 СН3 – С O
СН3 – С O
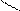
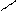 О + 2NaOH → 2CH3 – C + H2O
О + 2NaOH → 2CH3 – C + H2O
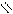 СН3 – С ONa
СН3 – С ONa
О
4.3.4. Висновок:з лугами реакція йде краще.
4.4. Одержання фенолфталеїну.
4.4.1. Хід роботи: в суху пробірку поміщають декілька кристалів фталевого ангідриду і 3 краплі рідкого фенолу, додають 1 краплю Н2SO4. Вміст пробірки нагрівають над полум’ям до сплавлення суміші. Суміш охолоджують і додають 5-6 крапель води. Наносять краплю розчину на кусок фільтрувального паперу, а коли крапля всмокчеться , поміщають в центрі плями 1 краплю розчину їдкого натру.
4.4.2. Спостереження: при сплавленні суміш забарвлюється в темно-червоний колір, після додавання натрію гідроксиду на папері з’являється малиново-червона пляма.
4.4.3. Хімізм реакцій:



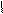
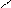



 НО ОН НО ОН
НО ОН НО ОН
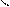
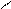
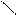
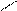
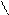
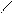 О [H2SO4] С
О [H2SO4] С
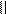

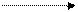 О
О
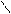
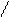


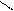 С - H2O
С - H2O
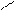
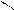 О С
О С
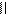
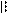
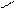 С
С
 О О
О О
4.4.4. Висновок: фенолфталеїн отримують конденсацією фталевого ангідриду з фенолом в присутності сульфатної кислоти.
4.5. Розчинність мила у воді.
4.5.1. Хід роботи: в пробірку поміщають кусочок мила (10мг) і добавляють 5 крапель води, збовтують вміст пробірки протягом 1-2 хв. Після цього вміст пробірки нагрівають у полум’ї пальника. Нагрівають також інші лужні мила (калієві, алюмінієві), які добре розчиняються у воді.
4.5.2. Спостереження: мило добре розчинне у воді.
4.5.3. Хімізм реакцій:
4.5.4. Висновок: натрієве та інші лужні мила добре розчинні у воді.
4.6. Виділення вільних жирних кислот із мила.
4.6.1. Хід роботи:в пробірку поміщають 5 крапель концентрованого розчину мила, добавляють одну краплю 2н р-ну H2SO4 і злегка підігрівають вміст пробірки в полум’ї пальника. Спливає білий маслянистий шар вільних жирних кислот, водний розчин освітлюється. Вміст пробірки залишають для наступних дослідів.
4.6.2. Спостереження:спливає білий маслянистий шар вільних жирних кислот, водний розчин освітлюється.
4.6.3. Хімізм реакцій:
С17Н35 – СООNa + Н2SО4 → С17Н35 – СООН + NaНSO4
4.6.4. Висновок: мила – це солі вищих насичених і ненасичених органічних кислот. Тверде мило – це суміш натрієвих солей пальмітинової, стеаринової і олеїнової кислоти.
4.7. Гідроліз спиртового розчину мила.
4.7.1. Хід роботи:в суху пробірку кладуть кусочок мила і 4 краплі спирту, енергійно збовтують і добавляють 1 краплю фенолфталеїну.
Колір не змінюється. До спиртового розчину добавляють по краплях дистильовану воду.
4.7.2. Спостереження: по мірі додавання дистильованої води з’являється рожеве забарвлення, його інтенсивність поступово збільшується.
4.7.3. Хімізм реакцій:
С17Н35СООNa + HOH → C17H35COOH + NaOH
С17Н35СООNa D [C17H35COO]- + Na+
[C17H35COO]- + НОН → C17H35COOH + ОН-
4.7.4. Висновок: розбавлення спиртового розчину мила водою викликає гідроліз мила. В результаті утворюються малодисоційовані жирні кислоти і натрій гідроксид. Рожеве забарвлення говорить про появу в розчині гідроксильних іонів. Реакція водних розчинів мила завжди лужна.
4.8. Утворення нерозчинних кальцієвих солей жирних кислот.
4.8.1. Хід роботи:в пробірку поміщають 2 краплі розчину мила, 1 краплю розчину кальцію хлориду і збовтують вміст пробірки.
4.8.2. Спостереження: випадає білий осад.
4.8.3. Хімізм реакцій:
2С17Н35СООNa + CaCl2 → (C17H35COO)2Ca + 2NaCl
4.8.4. Висновок:кальцієві солі жирних кислот (кальцієве мило) нерозчинні у воді. Кальцієве мило виділяється при митті в жорсткій воді.
КОНТРОЛЬНІ ЗАПИТАННЯ:
1. Написати рівняння реакцій гідролізу, алкоголізу і амонолізу для етилацетату, оцтового ангідриду, ацетилхлориду.
2. Здійснити синтези: з метану одержати етилацетат, оцтовий ангідрид, хлористий форміл, сечовину.
3. Скільки кг 70%-ної оцтової кислоти утвориться при окисленні 50 кг етилового спирту?
4. Із 30 кг оцтової кислоти одержали 38 кг оцтовогокислого етеру. Який це становить вихід у % від теоретичного?
5. Як правильно працювати з фенолом, оцтовим ангідридом, кислотами і лугами .
ЛІТЕРАТУРА:
А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980. Досліди: 105, 117, 118, 120, 121, 126, 127, 128.
Дата добавления: 2014-12-08; просмотров: 1334;
