КОНТРОЛЬНЫЕ ЗАДАНИЯ
Вариант 1
- При сгорании 1 л ацетилена C2H2 выделяется 58,0 кДж теплоты. Вычислите стандартную энтальпию реакции горения ацетилена ?
- При каком соотношении ∆H и T∆S системы находятся в равновесии ?
Вариант 2
- Вычислите тепловой эффект реакции восстановления 1 моля оксида железа (III) алюминием.
- Не производя вычислений, определите знак изменения энтропии для процесса:
а) CO2(к)  CO2(г)
CO2(г)
б) 2NH3(г)  N2(г) + 3H2(г)
N2(г) + 3H2(г)
в) 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж)
г) 2CH3OH(г) + 3O2(г) = 2CO2(г) + 4H2O(г)
Вариант 3
1. Пользуясь табличными значениями стандартных энтальпий образования, определите изменение стандартной энтальпии реакции
CaO + CO2 = CaCO3
- Почему при растворении в воде хлорида калия KCl энтропия увеличивается, а при растворении газообразного диоксида углерода CO2 – уменьшается ?
Вариант 4
- Что является термодинамическим критерием химического равновесия системы:
а) ∆Hо = 0 б) ∆Gо < 0 в) р = const г) ∆Gо = 0
- Определите теплоту образования оксида азота (I), исходя из уравнений реакций:
C + 2N2O  CO2 + 2N2, ∆Hо = -556,9 кДж;
CO2 + 2N2, ∆Hо = -556,9 кДж;
C + O2  CO2, ∆Hо = -393,7 кДж.
CO2, ∆Hо = -393,7 кДж.
Вариант 5
- В каком случае возможно самопроизвольное протекание химической реакции при стандартных условиях, если ∆Hо >> T∆Sо:
а) ∆Hо > 0 , ∆Sо < 0 б) ∆Hо > 0 , ∆Sо < 0
в) ∆Hо < 0 , ∆Sо > 0 г) ∆Hо < 0 , ∆Sо < 0
Дайте подробный ответ.
- Чем отличаются термохимическая и термодинамическая системы знаков для тепловых эффектов процессов и почему ?
Вариант 6
- Исходя из теплот образования жидкой воды и водяного пара, определите теплоту испарения воды.
- Рассчитайте температуру, при которой равновероятны оба направления реакции
CuO(к) + C(графит)  Cu(к) + CO(г)
Cu(к) + CO(г)
Вариант 7
- Вычислите стандартную энтальпию образования метилового спирта, исходя из следующих данных:
H2(г) + 1/2 O2(г) = H2O(ж), ∆H0 = -285,8 кДж;
C(гр) + O2(г) = CO2(г), ∆H0 = -393,7 кДж;
CH3OH(ж) + 3/2 O2(г) = CO2(г) + 2 H2O(ж) , ∆H0 = -715,0 кДж.
- Может ли протекать реакция самопроизвольно при положительном изменении энтальпии и изменении энтропии ?
Вариант 8
- Теплота образования октана C8H18 равна 199,28 кДж/моль. Определите теплоту сгорания 1 кг октана.
(Образующуюся при сгорании воду считать жидкой).
- Какую информацию о веществе можно получить, используя значение энергии Гиббса ?
Вариант 9
- Рассчитайте термодинамические характеристики процесса термического разложения карбоната кальция СаСО3.
- Почему в формуле для вычисления ∆G перед энтропийным членом стоит знак минус ?
Почему энтропийный фактор выражается произведением изменения энтропии на температуру ?
Вариант 10
1. При нейтрализации гидроксида натрия, какой массы хлороводородом по реакции
NaOH(к) + HCl(г) = NaCl(к) + H2O(ж)
выделяется 352,9 кДж теплоты ?
2. Рассчитайте температуру, при которой равновероятны оба направления реакции
2 SO2(г) + O2(г)  2 SO3(г).
2 SO3(г).
Вариант 11
- Рассчитайте, является ли реакция
Al2(SO4)3(к) = Al2O3(к) + 3SO3(г)
экзо- или эндотермической.
- Определите, рассчитав DS, возможность протекания реакции
2C(графит) + H2(г) = C2H2(г)
Вариант 12
- Определите знаки ∆Hо, ∆Sо и ∆Gо для реакции
AB(к) + B2(г)  AB3(гр),
AB3(гр),
протекающей при 298 К в прямом направлении.
Будет ли ∆Gо возрастать или убывать с ростом температуры ?
- Для реакций
Н2(г) + О (г) = Н2О(г) (1)
Н2(г) + 1/2О2(г) = Н2О(г) (2)
2Н(г) + О (г) = Н2О(г) (3)
укажите правильное соотношение стандартных изменений энтальпий:
а)  <
< 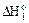 <
< 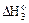 б)
б)  >
> 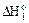 >
> 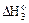
Вариант 13
- В каком из случаев:
а) ∆H < 0 , ∆S > 0; б) ∆H < 0 , ∆S < 0 или в) ∆H > 0 , ∆S > 0
реакция возможна при любых температурах ?
Ответ обоснуйте.
- Какой из оксидов – CuO или MgO – обладает наибольшим химическим сродством к серному ангидриду SO3 ?
Ответ подтвердите расчётом ∆Gо реакций.
Вариант 14
- Сколько теплоты выделится при сгорании 20 кг ацетилена C2H2 при стандартных условиях ?
- Если ∆H < 0 и ∆S < 0, то в каком из случаев:
а) ∆H > T ∆S или б) ∆H < T ∆S
реакция горения ацетилена может протекать самопроизвольно ?
Вариант 15
- Исходя из теплот реакций окисления оксида мышьяка (III):
As2O3 + O2 = As2O5 (∆H0 = –271 кДж),
3As2O3 + 2O3 = 3As2O5 (∆H0 = –1096 кДж),
определите теплоту образования озона из молекулярного кислорода.
- В каком из случаев
а) ∆H > 0 , ∆S > 0, б) ∆H > 0 , ∆S < 0 или в) ∆H < 0 , ∆S < 0
реакция неосуществима при любых температурах ?
Ответ обоснуйте.
Дата добавления: 2014-12-05; просмотров: 1613;
