В изолированных системах самопроизвольно могут совершаться только такие необратимые процессы, при которых энтропия системы возрастает (DS > 0).
Для неизолированных систем нужно учитывать не только изменение энтропии, но и изменение энергии. Поэтому необходимо рассматривать две тенденции, определяющие направление самопроизвольно протекающих процессов:
- стремление системы к достижению минимума энергии;
- стремление системы к максимуму энтропии, то есть к неупорядоченности.
Процессы, при которых энергия в неизолированной системе уменьшается, а энтропия возрастает, протекают самопроизвольно. Самопроизвольность других процессов зависит от того, какая из этих двух тенденций – энергетическая или энтропийная – окажется более эффективной, какая из этих противоборствующих тенденций получит перевес над другой. В этом проявляется противоречивость материального мира.
Для однозначной формулировки условий протекания самопроизвольных процессов в любых системах введена ещё одна термодинамическая функция, которая характеризует одновременно и энергетику, и неупорядоченность систем. Впервые такую термодинамическую функцию ввёл Д. У. Гиббс, и в память об этом выдающемся американском учёном её назвали энергией Гиббса (G).
| Джозайя Уиллард Гиббс (11.11 1839–28. IV 1903). Американский физик и физико-химик, член Национальной АН США (с 1879). Родился 11 февраля в Нью-Хейвене. Окончил Йельский университет (1858; доктор философии, 1863). В 1863–1866 преподавал в Йельском колледже. Совершенствовал образование в Сорбонне и Коллеж де Франс в Париже (1866–1867), в Берлинском (1867) и Гейдельбергском (1868) университетах. С 1871 – профессор Йельского университета. Один из основоположников термодинамики. | 
|
Предложил (1873) графические модели описания термодинамических свойств вещества. Разработал (1875–1878) теорию термодинамических потенциалов Изучил (1875) условия равновесия гетерогенных систем. Вывел (1875–1878) правило фаз, согласно которому в равновесной гетерогенной системе число фаз не может превышать числа компонентов системы, увеличенного на два. Предложил (1878) графическое изображение состояния трехкомпонентной системы (треугольник Гиббса). Заложил основы термодинамики поверхностных явлений и электрохимических процессов; ввёл понятие адсорбции. Дал (1902) атомистическое истолкование развитым им термодинамическим методам. Осуществил исследования в области векторного анализа и алгебры кратных чисел, электромагнитной и механической теорий света.
Член многих академий наук и научных обществ. Член Американской академии искусств и наук (с 1880).
Биохимические процессы обычно происходят при изобарно-изотермических условиях. В этих условиях энергетическое состояние системы характеризуется энтальпией, а мерой неупорядоченности системы будет произведение её энтропии и температуры. Функцией, учитывающей обе эти характеристики и противоположность в тенденции их изменения при самопроизвольных процессах, является энергия Гиббса:
G = Н -TS.
Энергия Гиббса является обобщённой термодинамической функцией состояния системы, учитывающей энергетику и неупорядоченность системы, при изобарно-изотермических условиях.
Энергию Гиббса называют также изобарно-изотермическим потенциаломили свободной энергией.
Подобно другим термодинамическим параметрам и функциям, характеризующим состояние системы, изменение энергии Гиббса в результате любого процесса определяется только конечным и начальным состоянием системы, независимо от пути процесса:
DG = Gкон - Gнач
Для полной энергетической характеристики вещества при стандартных условиях используют стандартную энергию Гиббса образования вещества DGо, значение которой дано в справочной литературе. Для простых веществ в термодинамически устойчивой форме стандартная энергия Гиббса их образования условно принята равной нулю.
Изменение энергии Гиббса в результате химической реакции при стандартных условиях вычисляют по уравнению:
DGр = ∑vкон DGкон (Yкон) - ∑vисх DGисх (Xисх),
где DGj(Yj), DGi(Xi) - стандартные энергии Гиббса продуктов реакции Yj и исходных веществ Xi;
vкон. и vнач - соответствующие стехиометрические коэффициенты в уравнении химической реакции.
Изменение энергии Гиббса для биохимических процессов при условиях, отличных от стандартных, рассчитывают на основе экспериментальных значений DН и DS для этих процессов по уравнению:
DG = DН - TDS,
где DН - характеризует полное изменение энергии системы при р, Т = const и отражает стремление системы к минимуму энергии;
TDS - характеризует ту часть энергии, которую нельзя превратить в работу, и отражает стремление системы к максимуму неупорядоченности;
DG - характеризует ту часть энергии, которую можно превратить в работу, и является термодинамическим критерием возможности самопроизвольного протекания любых процессов при р, Т = const.
Соотношение между изменениями важнейших термоди-намических параметров и функций состояний системы, описывающими химические и биохимические процессы при р, Т = const, представлено в таблице и на следующей схеме.
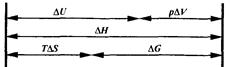
Второй закон термодинамики систем формулируется следующим образом: В системе при постоянных температуре и давлении самопроизвольно могут совершаться только такие процессы, в результате которых энергия Гиббса уменьшается (DGкон < DGнач или DG < 0).
Таким образом, в соответствии со II законом термодинамики самопроизвольно (DGр < 0) протекают экзотермические реакции (DНр < 0) при любой температуре, если они сопровождаются увеличением энтропии (DSp > 0). Эндотермические реакции (DНр > 0), сопровождающиеся уменьшением энтропии (DSp < 0), не могут протекать самопроизвольно при любой температуре, так как в этих случаях DGр > 0.
Дата добавления: 2014-12-05; просмотров: 2066;
