Биохимические реакции
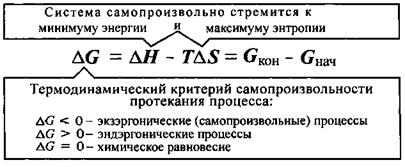
Биохимические реакции сопровождающиеся уменьшением энергии Гиббса (DGр < 0), называют экзэргоническими реакциями; они могут совершаться самопроизвольно. Если в течение экзэргонической реакции энергия Гиббса только понижается, как показано на рис. 1, то такая реакция протекает самопроизвольно и необратимо. Чем больше значение энергии Гиббса биохимической системы в начальном состоянии по сравнению с её значением в конечном состоянии, тем больше химическое сродство между реагентами в рассматриваемой системе, то есть их реакционная способность.
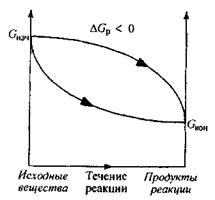
Рис. 1. Изменение энергии Гиббса в закрытой системе
в необратимых экзэргонических реакциях,
совершаемых самопроизвольно (р, Т = const)
Критерий DGp < 0 свидетельствует только о термодинамической возможности протекания данного процесса и ничего не говорит о скорости процесса и необходимых условиях для его начала.
Например, горение графита:
С + O2 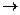 СО2
СО2
по законам термодинамики может происходить при стандартных условиях, так как 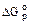 = -393,5 кДж/моль. Но графит при 298 К с молекулярным кислородом не реагирует, а чтобы реакция пошла, необходимо создать определённые условия (запал, катализатор) для увеличения её скорости.
= -393,5 кДж/моль. Но графит при 298 К с молекулярным кислородом не реагирует, а чтобы реакция пошла, необходимо создать определённые условия (запал, катализатор) для увеличения её скорости.
Биохимические реакции, сопровождающиеся увеличением энергии Гиббса (рис. 2), называются эндэргоническими (DGp > 0), и они невозможны без внешнего подвода энергии. Для того чтобы подобная реакция происходила, надо постоянно подводить энергию.
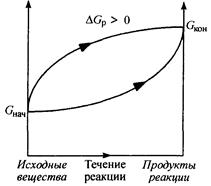
Рис. 2. Изменение энергии Гиббса в закрытой системе
в необратимых эндэргонических реакциях
(р, Т = const).
Например, процесс фотосинтеза в растениях идёт только под воздействием солнечной энергии:
6СО2 + 6Н2О  C6H12O6 + 6О2. DGp = +2870 кДж/моль.
C6H12O6 + 6О2. DGp = +2870 кДж/моль.
В живых системах эндэргонические реакции происходят за счёт их сопряжения с экзэргоническими реакциями.
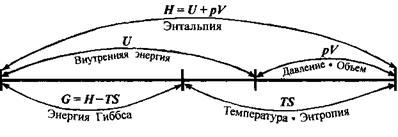
Таблица
р, Т = const
Взаимосвязь термодинамических величин
| ||||||
| ||||||
Химическое равновесие
|
5. ПРИНЦИП ЭНЕРГЕТИЧЕСКОГО СОПРЯЖЕНИЯ БИОХИМИЧЕСКИХ РЕАКЦИЙ
Живая клетка для своего существования нуждается в энергии. При этом некоторые (гетеротрофные) клетки получают необходимую энергию в основном за счёт окисления продуктов питания, а для некоторых (прототрофныхклеток источником энергии часто является солнечный свет. Полученная энергия переводится клетками обоих типов с довольно хорошим КПД (~40 %) в химическую энергию за счёт синтеза в них аденозинтрифосфорной кислоты (АТФ):
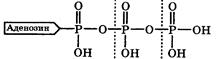
АТФ выполняет функцию аккумулятора энергии, так как при его гидролизе (расщеплении водой), образуются аденозиндифосфорная (АДФ) и ортофосфорная (Ф) кислоты и выделяется энергия. Поэтому АТФ называется макроэргическим соединением, а разрывающаяся при его гидролизе связь О–Р - макроэргической.
Макроэргической связью называется химическая связь, при гидролизе которой выделяется значительная энергия:
АТФ + Н2О ® АДФ + Ф DGр = -30,5 кДж/моль;
АДФ + Н2О ® АМФ + Ф 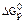 = -30,5 кДж/моль;
= -30,5 кДж/моль;
АТФ + 2Н2О ® АМФ + 2Ф, 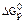 = -61,0 кДж/моль.
= -61,0 кДж/моль.
Разрыв любой химической связи (в том числе и макроэргической) всегда требует затраты энергии. В случае же гидролиза АТФ кроме процесса разрыва связи между фосфатными группами, для которого DG > 0, происходят процессы гидратации (присоединение воды), изомеризации и нейтрализации продуктов, образующихся при гидролизе. В результате этих процессов суммарное изменение энергии Гиббса имеет отрицательное значение (∑∆G < 0). Следовательно, макроэргическим является не разрыв связи, а энергетический результат реакции гидролиза.
АТФ функционирует в клетках как промежуточный продукт, обеспечивающий организм энергией, необходимой для протекания жизненно важных эндэргонических процессов: синтеза метаболитов (химическая работа), сокращения мышц (механическая работа), переноса вещества через мембраны против градиента концентрации (активный транспорт) и передачи информации (в частности, для передачи нервных импульсов).
Для протекания в живых системах эндэргонических реакций (DGp > 0), необходимо, чтобы они были сопряжены с экзэргоническими реакциями (DGp < 0). Такое сопряжение возможно, если обе реакции имеют какое-либо общее промежуточное химическое соединение и на всех стадиях сопряжённых реакций суммарный процесс характеризуется отрицательным значением изменения энергии Гиббса (Σ∆Gconp. p 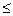 0).
0).
Например, синтез сахарозы является эндэргонической реакцией и самопроизвольно происходить не может:
Глюкоза + Фруктоза → Сахароза + Н2О, 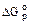 = +20,9 кДж/моль
= +20,9 кДж/моль
Однако сопряжение этой реакции с экзэргонической реакцией гидролиза АТФ, сопровождающееся образованием общего промежуточного соединения глюкозо-1-фосфата, приводит к тому, что суммарный процесс имеет ∑DGр < 0:
АТФ + Глюкоза + Фруктоза → Сахароза + АДФ + Ф,
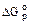 = -29,2 кДж/моль.
= -29,2 кДж/моль.
Наряду с АТФ в живых организмах имеются более эффективные макроэргические фосфорилированные соединения, гидролиз которых сопровождается выделением большей энергии. Так, стандартная энергия Гиббса для гидролиза креатинфосфата, 3-фосфоглицерилфосфата и фосфоенолпирувата равна соответственно -43,1, -49,4 и -61,9 кДж/моль. С помощью этих соединений происходит синтез АТФ из АДФ, а АДФ из АМФ.
Таким образом, внутренним источником энергии в живых системах являются фосфорилированные соединения, при взаимодействии которых с биосубстратами, включая воду, выделяется энергия. В результате сопряжения этих экзэргонических реакций с эндэргоническими реакциями обеспечивается протекание в клетке необходимых эндэргонических процессов.
6. ОСОБЕННОСТИ ТЕРМОДИНАМИКИ БИОХИМИЧЕСКИХ ПРОЦЕССОВ В РАВНОВЕСНЫХ И СТАЦИОНАРНЫХ СОСТОЯНИЯХ. ПОНЯТИЕ О ГОМЕОСТАЗЕ
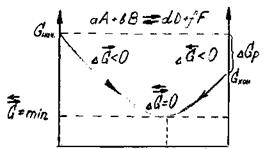
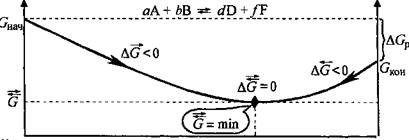
Отличительная особенность протекания обратимых биохимических реакций заключается в стремлении достичь динамического равновесия, так как это состояние возникает и поддерживается вследствие протекания реакций в двух противоположных направлениях с одинаковыми скоростями 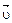 =
= 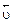 . Такое состояние называется химическим равновесием. В этом случае изменение энергии Гиббса в системе характеризуется наличием минимума, который соответствует состоянию химического равновесия (рис. 3, таблица). К равновесному состоянию возможен подход как со стороны исходных веществ (Δ
. Такое состояние называется химическим равновесием. В этом случае изменение энергии Гиббса в системе характеризуется наличием минимума, который соответствует состоянию химического равновесия (рис. 3, таблица). К равновесному состоянию возможен подход как со стороны исходных веществ (Δ 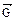 < 0), так и со стороны продуктов реакции (∆
< 0), так и со стороны продуктов реакции (∆ 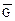 < 0).
< 0).
При протекании обратимых реакций система самопроизвольно приходит к состоянию химического равновесия, из которого она без внешнего воздействия выйти не может, поскольку это требует увеличения энергии Гиббса.
| Исходные вещества | Равновесный состав смеси исходных веществ и продуктов реакции | Продукты реакции |
Рис.3. Изменение энергии Гиббса в закрытой системе
в обратимой химической реакции
(р, Т = const)
Химическое и биохимическое равновесное состояние системы характеризуется:
- равенством скоростей прямой и обратной реакций ( 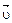 =
= 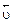 );
);
- энергетической выгодностью ( 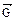 = min);
= min);
- отсутствием изменений величин параметров и функций состояния системы: концентрации реагентов, энтальпии, энтропии и энергии Гиббса ((Δ 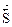 = О) (Δ
= О) (Δ 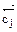 = 0) ( Δ
= 0) ( Δ 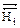 = 0) (ΔG =0)
= 0) (ΔG =0)
Поскольку в состоянии химического равновесия система достигает минимально возможного значения энергии Гиббса, то реакция, которая приводит в данных условиях к состоянию равновесия, всегда протекает самопроизвольно. Благодаря этой особенности обратимых процессов большинство биохимических реакций, протекающих в организме, обратимы.
Другая особенность биохимических процессов, протекающих в организме, заключается в их многостадийности, так как вероятность обратимого протекания отдельной стадии значительно выше, чем всего процесса в целом (рис. 4). Это объясняется тем, что разница между величинами (Gнач и Gкон для каждой отдельной стадии обычно невелика (| ΔGp | < 10 кДж/моль).
Обратимость отдельных стадий биохимических процессов позволяет живому организму легко регулировать синтез тех или иных соединений в зависимости от потребности и тем самым поддерживать стационарное состояние.
Стационарное состояние для живого организма характеризуется постоянством его термодинамических величин и неизменностью во времени скоростей поступления и удаления веществ и энергии. Несмотря на постоянство термодинамических величин, они не имеют равновесных значений в этом состоянии. Биологическое развитие организма возможно только в системе, находящейся в стационарном состоянии, но далёком от равновесия. Именно стационарное неравновесное состояние живой материи позволяет ей оптимизировать свои характеристики и эволюционировать во времени.
Термодинамическая особенность стационарного состояния открытых систем впервые сформулирована И. Р. Пригожиным (1946 г.)*.
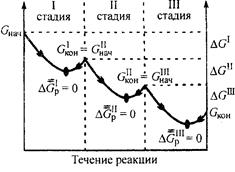
Рис. 4. Изменение энергии Гиббса в многостадийном
биохимическом процессе
(р, Т = const)
В открытой системе в стационарном состоянии прирост энтропии в единицу времени принимает минимальное положительное значение ( ΔS / Δτ → min).
Поскольку энтропия является мерой деградации, или рассеяния энергии, принцип Пригожина приводит к важнейшему заключению: при стационарном состоянии рассеяние энергии Гиббса открытой системой оказывается минимальным.
Термодинамические особенности открытых систем, характерные для живого организма, объясняют его устойчивость, позволяющую ему в течение многих лет сохранять определённый уровень работоспособности, а также относительное постоянство внутренней среды, называемое в биологии гомеостазом.
Гомеостаз – относительное (!) динамическое постоянство состава и свойств внутренней среды организма, обуславливающее устойчивость его физиологических функций.
В формировании и поддержании состояния гомеостаза большую роль играет обратимость большинства биохимических процессов. Эти процессы всегда протекают самопроизвольно в направлении достижения равновесия, но, как правило, в организме они его не достигают, а только приводят к достижению необходимого соотношения между конечными и исходными продуктами реакции, протекающей самопроизвольно при данных условиях. Это происходит или за счёт использования продуктов реакции, протекающей самопроизвольно в других процессах, или за счёт изменения условий в данной системе. Так, система, приближающаяся к химическому равновесию, переносится организмом в другие условия, при которых к состоянию химического равновесия приводит обратная реакция. Например, в лёгких, где концентрация кислорода большая, гемоглобин крови соединяется с ним, но, не достигнув состояния равновесия в насыщении кислородом, кровь переносится из лёгких к тканям, и там гемоглобин отдаёт О2, поскольку при переходе от лёгких к тканям в крови изменяются условия для процесса взаимодействия гемоглобина с кислородом. Другой пример: формирование и рост костной ткани происходит в одних клетках - остеобластах,* а её растворение - в других клетках - остеокластах,** в то же время работа клеток обоих типов регулируется организмом, что позволяет ему поддерживать содержание костной ткани на определённом уровне.
Организм, таким образом, использует в своей жизнедеятельности обратимые биохимические процессы и их стремление к состоянию химического равновесия, но не допускает наступления устойчивого во времени химического равновесия, так как это состояние приведёт к гибели организма. В то же время состояние гомеостаза поддерживается за счёт баланса, то есть необходимого соотношения между компонентами с противоположными (антагонистическими) свойствами. Так, в основе гомеостаза организма находятся следующие химические и физико-химические балансы: кислотно-основный, окислительно-восстановительный, металло-лигандный, гидрофильно-липофильный, водно-электролитный. В литературе понятия "баланс" и "гомеостаз" часто используются как синонимы.
Заключение
Основные положения, следующие из законов термодинамики:
- развитие системы происходит под влиянием двух тенденций - стремления к минимуму энергии и к максимуму энтропии;
- экзэргонические реакции в организме протекают самопроизвольно, так как ΔGр < 0;
- эндэргонические реакции требуют подвода энергии, так как DGp > 0;
- состояние равновесия в обратимых процессах с позиции термодинамики характеризуется ∆ 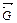 = 0 и является энергетически самым выгодным, так как
= 0 и является энергетически самым выгодным, так как 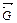 = min;
= min;
- биологические системы в стационарном состоянии характеризуются DS/Δτ → min, а в соответствии с законом сохранения S + I = const для живых систем должна быть справедлива закономерность Δ I/Δτ → max (в пределах соблюдения приведённого закона сохранения). При этом биологические системы организма далеки от состояния равновесия, что позволяет им оптимизировать свои характеристики и эволюционировать во времени.
Законы биохимической термодинамики дают биологу, врачу и экологу ключ к пониманию энергетической стороны биохимических реакций в организме, процессов эмбриогенеза,* регенерации** и старения тканей, аналогичных процессов, протекающих в биосфере, а также дают возможность регулировать эти процессы осуществлением профилактических или исправляющих (лечебных) мероприятий.
Дата добавления: 2014-12-05; просмотров: 5920;

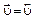
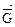 = 0
= 0
 = О
= О