СТАНДАРТНЫЕ ЭНТАЛЬПИИ ОБРАЗОВАНИЯ, ЭНТРОПИИ И ЭНЕРГИИ ГИББСА ОБРАЗОВАНИЯ
НЕКОТОРЫХ ВЕЩЕСТВ ПРИ 298 К (25 оС)
| Вещество | 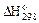 ,
кДж / моль ,
кДж / моль
| 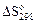 ,
Дж / (моль∙К) ,
Дж / (моль∙К)
| 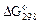 ,
кДж / моль ,
кДж / моль
|
| Al2O3 (к) | –1676,0 | 50,9 | –1582,0 |
| С (графит) | 5,7 | ||
| ССl4 (ж) | –135,4 | 214,4 | –64,6 |
| СН4 (г) | –74,9 | 186,2 | –50,8 |
| С2Н2 (г) | 226,8 | 200,8 | 209,2 |
| С2Н4 (г) | 52,3 | 219,4 | 68,1 |
| С2Н6 (г) | –89,7 | 229,5 | –32,9 |
| С6Н6 (ж) | 82,9 | 269,2 | 129,7 |
| С2Н5ОН (ж) | –277,6 | 160,7 | –174,8 |
| С2Н12О6 (глюкоза) | –1273,0 | – | –919,5 |
| СО (г) | –110,5 | 197,5 | –137,1 |
| СО2 (г) | –393,5 | 213,7 | –394,4 |
| СаСО3 (к) | –1207,0 | 88,7 | –1127,7 |
| СаF2 (к) | –1214,6 | 68,9 | –1161,9 |
| Са3N2 (к) | –431,8 | 105,0 | –368,6 |
| Са(ОН)2 (к) | –986,6 | 76,1 | –896,8 |
| Cl2 (г) | 222,9 | ||
| Cl2О (г) | 76,6 | 266,2 | 122,3 |
| ClО2 (г) | 105,0 | 257,0 | 122,3 |
| Cl2О7 (ж) | 251,0 | – | – |
| Cr2О3 (к) | –1440,6 | 81,2 | –1050,0 |
| CuO (к) | –162,0 | 42,6 | –129,9 |
| FeO (к) | –264,8 | 60,8 | –244,3 |
| Fe2O3 (к) | –822,2 | 87,4 | –740,3 |
| Fe3O4 (к) | –1117,1 | 146,2 | –1014,2 |
| Н2 (г) | 130,5 | ||
| НBr (г) | –36,3 | 198,6 | –53,3 |
| НСN (г) | 135,0 | 113,1 | 125,5 |
| НСl (г) | –92,3 | 186,8 | –95,2 |
| НF (г) | –270,7 | 178,7 | –272,8 |
| НI (г) | 26,6 | 206,5 | 1,8 |
| НN3 (ж) | 294,0 | 328,0 | 238,8 |
| Н2О (г) | –241,8 | 188,7 | –228,6 |
| Н2О (ж) | –285,8 | 70,1 | –237,3 |
| Н2S (г) | –21,0 | 205,7 | –33,8 |
| КСl (к) | –435,9 | 82,6 | –408,0 |
Продолжение Таблицы
| Вещество | 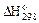 ,
кДж / моль ,
кДж / моль
| 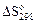 ,
Дж / (моль∙К) ,
Дж / (моль∙К)
| 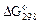 ,
кДж / моль ,
кДж / моль
|
| КСlО3 (к) | –391,2 | 143,0 | –289,9 |
| MgCl2 (к) | –641,1 | 89,9 | –591,6 |
| Mg3N2 (к) | –461,1 | 87,9 | –400,9 |
| MgO (к) | –601,8 | 26,9 | –569,6 |
| N2 (г) | 191,5 | ||
| NН3 (г) | –46,2 | 192,6 | –16,7 |
| NН4NO2 (к) | –256,0 | – | – |
| NН4NO3 (к) | –365,4 | 151,0 | –183,8 |
| N2О (г) | 82,0 | 219,9 | 104,1 |
| NO (г) | 90,3 | 210,6 | 86,6 |
| N2О3 (г) | 83,3 | 307,0 | 140,5 |
| NО2 (г) | 33,5 | 240,2 | 51,5 |
| N2О4 (г) | 9,6 | 303,8 | 98,4 |
| N2О5 (к) | –42,7 | 178,0 | 114,1 |
| NiO (к) | –239,7 | 38,0 | –211,6 |
| О2 (г) | 205,0 | ||
| ОF2 (г) | 25,1 | 247,0 | 42,5 |
| Р2О3 (к) | –820,0 | 173,5 | – |
| Р2О5 (к) | –1492,0 | 114,5 | –1348,8 |
| PbO (к) | –219,3 | 66,1 | –189,1 |
| PbO2 (к) | –216,3 | 74,9 | –218,3 |
| SO2 (г) | –296,9 | 248,1 | –300,1 |
| SO3 (г) | –395,8 | 256,7 | –371,2 |
| SiСl4 (ж) | –687,8 | 239,7 | – |
| SiН4 (г) | 34,7 | 204,6 | 57,2 |
| SiO2 (кварц) | –910,9 | 41,8 | –856,7 |
| SnO (к) | –286,0 | 56,5 | –256,9 |
| SnO2 (к) | –580,8 | 52,3 | –519,3 |
| Ti (к) | 30,6 | ||
| ТiСl4 (ж) | –804,2 | 252,4 | –737,4 |
| ТiО2 (к) | –943,9 | 50,3 | –888,6 |
| WO3 (к) | –842,7 | 75,9 | –763,9 |
| ZnO (к) | –350,6 | 43,6 | –320,7 |
СОДЕРЖАНИЕ
1. Основные термины
2. Первый закон термодинамики
3. Понятие о самопроизвольных процессах. Энтропия
4. Второй закон термодинамики. Энергия Гиббса
5. Принцип энергетического сопряжения биохимических реакций
6. Особенности термодинамики в биохимических процессах в равновесных и стационарных состояниях. Понятие о гомеостазе
Заключение
Контрольные задания
Типовые тестовые задания
Список литературы
Приложение
АГТУ. Заказ № . Тираж 50 экз. 2006 г.
[*] Система – от греч. sistema (буквально – “целое, составленное из частей)
* Термин «теплосодержание» сохранился исторически (под влиянием некогда господствовавшей в физике теории теплорода) и может создать впечатление, что он характеризует просто «количество теплоты в теле» (в то время как в действительности теплосодержание – это мера энергии, накапливаемой веществом при его образовании). Поэтому в химической литературе вместо термина «теплосодержание» пользуются термином «энтальпия» (от греч. enthalpo – нагреваю).
* in vitro – вне организма, буквально в стекле.
* Конечным продуктом азотистого обмена в организме в действительности является не свободный азот, а такие продукты неполного сгорания, как мочевая кислота, мочевина, аммонийные соли, однако на практике принято вести расчёты, предполагая образование молекулярного азота.
* Пригожин Илья Романович – лауреат Нобелевской премии, бельгийский физик и физикохимик, один из создателей неравновесной термодинамики. Родился в Москве, вместе с родителями эмигрировал из России в 1920 г.
* Остеобласты (от греч. ostéon – кость и blastós – росток, зародыш) – клетки, синтезирующие материал волокон и основного вещества костной ткани и регулирующие поток ионов Са2+ в очагах костеобразования.
** Остеокласты (от osteo – кость и греч. kláo – ломаю, разбиваю) – костедробители, обычно многоядерные крупные клетки, разрушающие костную ткань.
* Эмбриогенез (от греч. émbrion – зародыш животных и человека и génesis – происхождение) – зародышевое развитие.
** Регенерация (от позднелат. regeneratio – возрождение, возобновление) – восстановление организмом утраченных или повреждённых органов и тканей. Термин предложен в 1712 г. французским естествоиспытателем Р. Реомюром.
Дата добавления: 2014-12-05; просмотров: 3568;
