Решение. Рассчитаем количество моль-эквивалентов образовавшегося Fe(OH)2:
Рассчитаем количество моль-эквивалентов образовавшегося Fe(OH)2:
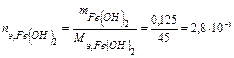 моль-экв.
моль-экв.
Поскольку все вещества взаимодействуют в эквивалентных количествах, то разрушилось 2,8.10-3 моль-экв. Fe и израсходовалось столько же моль-экв O2. 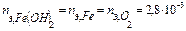 моль-экв.
моль-экв.
Тогда объем кислорода (н.у.), израсходованного на коррозию железа: 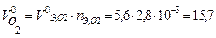 мл.
мл.
По закону Фарадея рассчитаем силу коррозионного тока 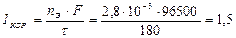 А.
А.
Определим массу прокорродировавшего железа: 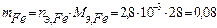 г.
г.
Атмосферная коррозия - коррозия М в атмосферных условиях. Первопричина – увлажнение и загрязнение поверхности М. Загрязнители (газы SO2, СО, СО2, NOx…) растворяются во влажной пленке на М:
СО2 + Н2 О ↔ Н2СО3↔Н+ + НСО3-(рН падает, Соx увеличивается)
Дата добавления: 2014-12-03; просмотров: 927;
