Задача 13.
Влияние рН среды на коррозию железа Fe с примесями меди Cu (рН = 3 и рН =10).
Решение.
1) Сравниваем потенциалы металлов (основного и примесей, компонентов сплава, основного металла и покрытия и т.д.). Стандартные потенциалы: ЕоFe2+/Fe = - 0,44 В < ЕоCu2+/Cu = + 0,34 В Разрушаться (окисляться) будет металл с более отрицательным потенциалом (более сильный восстановитель), т.е. Fe.
2) Определяем равновесные потенциалы окислителей в заданной среде:
рН = 3 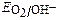 ≈ 1,23 – 0,059рН ≈ 1,05 В,
≈ 1,23 – 0,059рН ≈ 1,05 В, 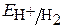 ≈ – 0,059рН ≈ -0,18 В
≈ – 0,059рН ≈ -0,18 В
рН = 10 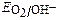 ≈ 1,23 – 0,059рН ≈ 0,64 В,
≈ 1,23 – 0,059рН ≈ 0,64 В, 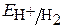 ≈ – 0,059рН ≈ -0,59 В
≈ – 0,059рН ≈ -0,59 В
3) Сравниваем значения потенциалов окислителей и металла, делаем вывод о возможности данного процесса коррозии:
рН = 3 - 0,44 В < 1,05 В Þ возможна коррозия с поглощением кислорода
- 0,44 В < -0,18 В Þвозможна коррозия с выделением водорода
рН = 10 - 0,44 В < 0,64 В Þвозможна коррозия с поглощением кислорода
- 0,44 В > -0,59 В Þневозможна коррозия с выделением водорода
4) Записываем уравнения коррозионных процессов:
рН = 3
(A): Fe → Fe2+ + 2 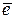
(К): 2H+ + 2 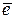 → H2
→ H2
O2 + 4H+ + 4 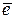 → 2H2O -
→ 2H2O -
есть синее окрашивание: K3[Fe(CN)6] - качественный реагент на ионы Fe2+(гексоцианоферрат калия):
2 K3[Fe(CN)6] +3 Fe2+ = Fe3[Fe(CN)6]2 + 6 K+
синий цвет – «турнбулева синь».
рН = 10
(A): Fe → Fe2+ + 2 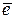
O2 + 2H2O + 4 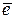 → 4OH_ нет синего окрашивания → пассивация Fe: Fe(OH)2
→ 4OH_ нет синего окрашивания → пассивация Fe: Fe(OH)2
Дата добавления: 2014-12-03; просмотров: 744;
