Задача 17.
Напишите уравнения электрохимической коррозии пары Sn-Zn при рН=5 и 298 К. Сколько и какого металла прокорродировало, если в процессе коррозии поглотилось 56 мл кислорода и выделилось 22,4 мл водорода? Определите, чему равен коррозионный ток, если продолжительность коррозии 20 мин.
Решение.
Стандартные потенциалы металлов:
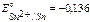 B,
B, 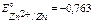 B,
B,
т.к. 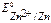 <
< 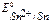 то в заданной гальванической паре анодом будет цинк, а катодом – олово.
то в заданной гальванической паре анодом будет цинк, а катодом – олово.
По уравнению Нернста определим равновесные потенциалы вероятных окислителей ( Н+ и О2):
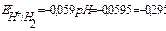 В,
В, 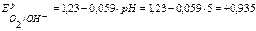 В.
В.
Так как 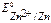 <
< 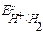 ,
, 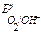 , то в данной среде термодинамически возможна электрохимическая коррозия цинка с кислородной и водородной деполяризацией:
, то в данной среде термодинамически возможна электрохимическая коррозия цинка с кислородной и водородной деполяризацией:
A- : Zn → Zn2+ + 2 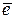
K+ : O2 + 2H2O + 4 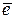 → 4OH-
→ 4OH-
2H2O + 2 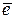 → H2 + 2OH- .
→ H2 + 2OH- .
В соответствии с заданием определим количество моль-экв. поглотившегося кислорода и выделившегося водорода (условия считаем нормальными, 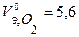 л/моль,
л/моль, 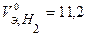 л/моль):
л/моль):
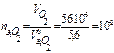 моль-экв,
моль-экв, 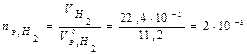 моль-экв.
моль-экв.
Таким образом, на катоде претерпело изменение 1,2.10-2 моль-эквивалентов вещества. По закону эквивалентов такое же количество вещества растворится на аноде: 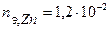 . Масса прокорродировавшего цинка (с учетом массы моля эквивалента цинка
. Масса прокорродировавшего цинка (с учетом массы моля эквивалента цинка 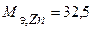 г/моль) равна:
г/моль) равна:
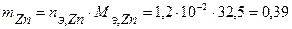 г.
г.
Величина коррозионного тока определяется по закону Фарадея:
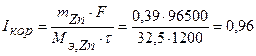 А.
А.
Дата добавления: 2014-12-03; просмотров: 1647;
