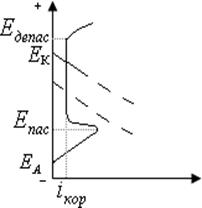
Коррозионная диаграмма
.
Как и в гальваническом элементе, потенциал анодного процесса смещается в более положительную сторону, а катодного - в более отрицательную. При некотором токе iкор кривые пересекаются - ток анодного растворения равен току катодного восстановления окислителя. При этом на поверхности металла устанавливается стационарный потенциал Ес, или потенциал коррозии Екор.
1) Лимитирующая стадия – катодное выделение водорода (обычно в кислых средах). Замедленность стадии определяется электрохимической поляризацией при выделении Н2: 2Н+ +2 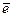 → Н2.
→ Н2.
Такие примеси как платина, кобальт, никель катализируют выделение водорода, скорость катодного процесса будет выше, чем на чистом М (поляризация катодной кривой уменьшится) Þточка пересечения сместится вправо, то есть iкор увеличится Þ i’.
Другие металлы (например, Hg, Pb, Cd, Zn), напротив, увеличивают перенапряжение водорода (поляризация катодной кривой увеличится), iкор уменьшится Þ i”.
V = f (рН, Т, природа катодных участков)
Вывод: Скорость коррозии с выделением водорода может быть замедлена снижением температуры, увеличением pH среды, очисткой металла от каталитических примесей, изоляцией поверхности металла. Перемешивание раствора практически не влияет, т.к. поляризация электрохимическая.
2) Лимитирующая стадия – катодное восстановление кислорода. Замедленность вызвана медленной диффузией кислорода из-за его малой растворимости в воде (при 25оС растворимость О2 составляет 2,6.10-7 моль/см3). Поляризация - концентрационная, зависит от СО2 (концентрации кислорода в растворе), D (коэффициента диффузии кислорода), δ (толщины диффузионного слоя), Т. Максимальная скорость определяется предельной плотностью тока iпр= 4F.DO2.СO2.δ-1
V = f(CО2, D, T)
↑Т приводит к ↑D, но и к уменьшению растворимости кислорода в воде.
Вывод: коррозия с поглощением кислорода лимитируется стадией диффузии кислорода и возрастает с увеличением его концентрации и при перемешивании, экстремально зависит от температуры (в системе, сообщающейся с атмосферой, максимум при Т=70-800 С).
Для борьбы с такой коррозией следует снижать концентрацию кислорода, например, введением восстановителя в раствор (Na2SO3 - сульфит натрия, N2H4 - гидразин…) или снижением давления кислорода над раствором, подбором оптимальной Т, применением ингибиторов (ПАВ), избегать перемешивания.
3) Лимитирующая стадия – анодное окисления металла (для металлов, способных пассивироваться, таких, как 13Al, 22Ti, 24Cr, 28Ni, 40Zr, 73Ta и др.).
Пассивность – состояние повышенной устойчивости М,которое вызывается образованием на поверхности металла оксидных или иных защитных слоев (плотной труднорастворимой пленки из продуктов коррозии, например, Сr2О3 на хроме, ТiО2 на титане, Al2О3 на алюминии, Та2О5 на тантале), и приводит к торможению анодной реакции в определенной области потенциалови скорости электрохимической коррозии в целом. При некотором потенциале Епас скорость растворения анода резко падает Þметалл переходит в пассивное состояние. Во всей области пассивности 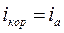 . В области пассивности анодное растворение протекает крайне медленно.
. В области пассивности анодное растворение протекает крайне медленно.
Дата добавления: 2014-12-03; просмотров: 1721;
