Коррозия металлов
Задача 12
Определите объем Cl2, выделившийся при электролизе водного раствора NaCl на платиновых электродах, если объем выделившегося при этом Н2 44,8 мл. Выход по току хлора – 80%.
Решение.
Ионный состав раствора:
NaCl → Na+ + 2l- рН =7 гидролизa соли нет
H2O ↔ H+ + OH-
Потенциалы возможных процессов:
ЕрН+/Н2 = -0,059рН = -0,41В
ЕрО2/ОН- =1,23-0,059рН = +0,81В;
Е0Сl2/Cl- = + 1,36В
Е0Сl2/Cl- - ЕрО2/ОН- < 1 Þ возможны оба процесса
Электродные процессы:
[- K]: 2Н+ + 2е → Н2↑
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4е
2Cl- → Cl2 + 2e
По закону Фарадея:
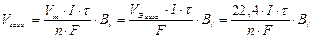
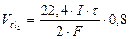
Количество электричества, прошедшее через электроды: qk = qa =I·τ
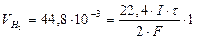 Þ
Þ 
Þ 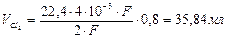
Коррозия металлов
Коррозия - самопроизвольное и необратимое разрушение металла под действием компонентов окружающей среды - окислителей.
В результате коррозии металл – окисляется, теряет электроны, переходит в форму соединения, а окислители из окружающей среды восстанавливаются, забирают электроны у металла: nM + mOx → MnRedm (1)
Коррозия - процесс самопроизвольный, то есть 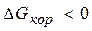 .
.
Для большинства металлов ΔfG0 < 0. В природе металлы встречаются в основном в виде соединений. Процесс получения металлов из соединений, наоборот, вынужденный, требует затраты энергии.
Убытки от коррозии- миллиарды рублей ежегодно (разрушение трубопроводов, цистерн, машин, корпусов судов, морских сооружений и т. п.; безвозвратные потери металлов более 15% от их производства; косвенные убытки часто превышают прямые потери - выход из строя парового котла, обшивки танкера и пр.). Экологический аспект. 2-я половина прошлого века создана теория коррозии,борьба с ней приняла целенаправленный характер.
Классификация коррозии:
(по механизму протекания, по условиям протекания, по характеру разрушения)
1) По механизму протекания:
· Химическая коррозияпротекает в неэлектропроводных средах, как гетерогенная окислительно-восстановительная реакция в непроводящих средах.
· Электрохимическая коррозияпротекает в электропроводящих средах как электрохимическая реакция.
Химическая коррозия:
а) газовая иливысокотемпературная коррозия (ВТК) -в газах и парах при высоких температурах;
б) в неэлектролитах - агрессивных органических жидкостях (сернистая нефть и др.).
Происходит прямое взаимодействие металла с окислителем окружающей среды, непосредственныйпереход электронов металла на окислитель. Критерий возможности протекания ∆ G < 0
Электрохимическая коррозия:
протекает в средах, имеющих ионную проводимость:
· в электролитах - в водных растворах солей, кислот, щелочей, в морской воде;
· в атмосфере любого влажного газа;
· в почве (в т.ч. коррозия под действием блуждающего тока.
При электрохимической коррозии на энергетически неоднородной металлической поверхности возникают локальные ГЭ: участки с более отрицательными потенциалами оказываются анодами, на них идет анодное растворение М, участки с более положительными потенциалами - катодами, на них идет катодное восстановление окислителя. Процессы разделены пространственно, идут на разных участках поверхности.
Отличие коррозионного ГЭ от обычного: отсутствие внешней цепи, т.е. КГЭ является короткозамкнутым.от обычного явл.нного Г.Э.ьным Е оказываются анодамиозникают локальные Г.
На анодном участке А: M → Mn+(р) + n 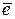
На катодном участке К: Ox + n e = Red
2)По характеру разрушения поверхности
Ø Общая –примерно равномерное разрушение всей поверхности металла
Ø Местная – пятнами, язвами, точечная (питтинг), сосредоточена на отдельных участках, проникает на большую глубину
Ø Межкристаллитная – разрушение по границам зерен металла (где скапливаются примеси)
Ø Избирательная – растворение одного из компонентов сплава (более активного восстановителя)
Дата добавления: 2014-12-03; просмотров: 1130;
