По условиям протекания
Ø Коррозия под напряжением (химическое и механическое воздействие):
коррозионное растрескивание (КР) - под действием растягивающих напряжений (нержав. стали – образование транскристаллитных трещин),
коррозионная усталость (КУ) - под действием циклических напряжений (атмосферная, почвенная и др.)
Ø Блуждающими токами(подземные коммуникации, трубопроводы) при недостаточной изоляции рельсов электротранспорта от земли и утечке тока.
Термодинамика и механизм электрохимической коррозии
При электрохимической коррозии:
на анодных участках А: М → Мn+ + n 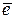
на катодных участках K: Ox + n 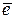 → Red .
→ Red .
Один процесс идет за счет другого (без другого не может идти). Такие процессы называют сопряженными.
Коррозионный ГЭ работает, пока ЭДС > 0 или Е кат. > Е анод.
Условие возможности электрохимической коррозии: 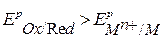
ЕРOx/Red - равновесный потенциал окислителя в данной среде
ЕРMn+/M - равновесный потенциал металла в данной среде
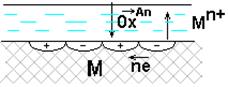
Поверхность М, как правило, энергетически неоднородна (пятна оксида, красок, недостаточная чистота обработки и др.)
Самые распространенные окислители:
а) О2 воздуха (в том числе растворенный в электролите)
Расчет по уравнению Нернста (часто рО2= 0,21): 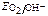 = 1,227 + 0,0147 lg
= 1,227 + 0,0147 lg 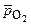 – 0,059рН ,
– 0,059рН ,
б) ионы Н+ из электролита или молекул H2O.
Расчет по уравнению Нернста: 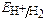 = – 0,059рН - 0,0295 lg
= – 0,059рН - 0,0295 lg 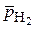 (часто рн2 =1)
(часто рн2 =1)
Уравнения катодных реакций (восстановления окислителей)
- коррозия с поглощением кислорода (с кислородной деполяризацией):
O2 + 4H+ + 4 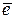 → 2H2O pH < 7
→ 2H2O pH < 7
O2 + 2H2O + 4 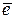 → 4OH- pH ³ 7
→ 4OH- pH ³ 7
- коррозия с выделением водорода (с водородной деполяризацией):
2H+ + 2 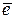 → H2 pH < 7
→ H2 pH < 7
2H2O + 2 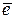 → H2 + 2OH– pH ³ 7
→ H2 + 2OH– pH ³ 7
Потенциал окислителя можно определить по диаграмме электрохимической устойчивости воды. Приведенная запись анодного процесса полностью его не отражает, т.к. идет и взаимодействие с компонентами среды. Упрощенная схема взаимодействий:
М
Н2О ↓ А-
М(ОН)2 ([М(ОН)3]-) ← М2+→ МА2 ([МА3]-)
Расчет по уравнению Нернста сложен. Для определения Е в водных растворах используют диаграммы Пурбэ. В ориентировачных расчетах используют Е0мет., т.е. для установления термодинамической возможности
 коррозии металла проверяют соблюдение неравенства: Е0мет < Еоx. Разные металлы корродируют по-разному, в зависимости от их стандартного потенциала и рН:
коррозии металла проверяют соблюдение неравенства: Е0мет < Еоx. Разные металлы корродируют по-разному, в зависимости от их стандартного потенциала и рН:
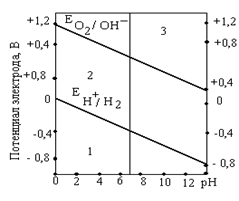
Зависимость потенциалов водородного и кислородного электродов от рН среды
а) если потенциал металла положительнее потенциала кислородного электрода (область 3), то коррозия металла невозможна. Например, золото, платина не могут корродировать ни с поглощением О2, ни с выделением Н2, так как Еок < 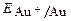 .
.
б) если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода (область 2), то коррозия возможна с поглощением кислорода и невозможна с выделением водорода, например: 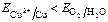 и
и 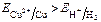
в) если потенциал металла отрицательнее потенциала водородного электрода, то возможна коррозия как с поглощением кислорода, так и с выделением водорода (область 1) (щелочные, щелочно-земельные металлы, магний, алюминий, цинк и др. цветные металлы).
Дата добавления: 2014-12-03; просмотров: 902;
