Решение. В соответствии с уравнением (10):
В соответствии с уравнением (10):
ΔН 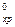 = 3 ΔН
= 3 ΔН 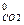 + 4 ΔН
+ 4 ΔН 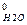 – ΔН
– ΔН 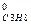 – 5 ΔН
– 5 ΔН 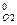 ,
,
откуда
ΔН 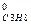 = – ΔН
= – ΔН 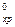 + 3 ΔН
+ 3 ΔН 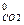 + 4 ΔН
+ 4 ΔН 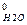 – 5 ΔН
– 5 ΔН 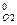 ,
,
Подставив значение ΔН 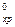 и справочные данные из табл. 1 Приложения, получим:
и справочные данные из табл. 1 Приложения, получим:
ΔН 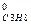 = –(–2043,86) + 3(–393,51) + 4(–241,82) –5∙0 = -103,85 кДж/моль.
= –(–2043,86) + 3(–393,51) + 4(–241,82) –5∙0 = -103,85 кДж/моль.
Как видно, реакция образования пропана относится к экзотермическим реакциям.
В общем случае тепловой эффект химического процесса зависит от температуры и давления, при которых осуществляется химическое превращение. Влиянием давления на ΔU и ΔН реакции обычно пренебрегают.
Теплоёмкостью с называют количество теплоты, необходимое для нагревания 1г (удельная теплоёмкость) или 1 моля (молярная теплоёмкость) вещества на 1 К.
с = 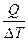 . (12)
. (12)
С повышением температуры теплоёмкость твёрдых, жидких и газообразных веществ увеличивается.
Различают истинную теплоёмкость, т.е. при теплоёмкость при данной температуре
с = 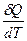 (13)
(13)
и среднюю теплоёмкость
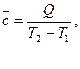 (14)
(14)
которая соответствует конечному интервалу температур. При незначительной величине интервала теплоёмкость считают не зависящей от температуры.
В зависимости от условий нагревания теплоёмкость бывает изобарной ср и изохорной сv:
ср = 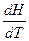 , (15)
, (15)
сv = 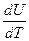 . (16)
. (16)
Для выведения зависимости теплового эффекта от температуры продифференцируем уравнение (6):
Qp = ΔН = H2 – H1,
учитывая уравнение (14), получаем:
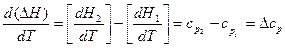 . (17)
. (17)
Уравнение (17) называют уравнением Кирхгофа, где Δср – это разность молярных теплоёмкостей продуктов реакции и исходных веществ с учётом стехиометрических коэффициентов.
Для вычисления теплового эффекта при заданной температуре Т, необходимо проинтегрировать уравнение Кирхгофа:
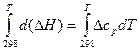 , (18)
, (18)
ΔНТ = ΔН 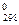
 +
+ 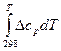 . (19)
. (19)
В широком диапазоне температур зависимость теплоёмкости веществ от температуры выражается в виде эмпирических уравнений:
ср = a + bT + 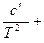 c·T2. (20)
c·T2. (20)
Коэффициенты a, b, c, c' для продуктов реакции и исходных веществ приводятся в справочниках, далее вычисляют Δa, Δ b, Δc, Δ c' как суммы соответствующих величин для продуктов реакции, умноженные на стехиометрические коэффициенты минус соответствующие значения для исходных веществ. Затем зависимость
Δ ср = Δa + ΔbT + 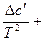 Δc·T2 (21)
Δc·T2 (21)
подставляются под знак интеграла в уравнение (19) и производится расчёт ΔНТ по правилам интегрирования.
При использовании табличных значений средних теплоемкостей 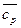 величина Δ
величина Δ 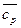 является постоянной и может быть вынесена из-под знака интеграла:
является постоянной и может быть вынесена из-под знака интеграла:
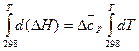 , (22)
, (22)
ΔНТ = ΔН 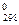 +
+ 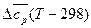 . (23)
. (23) 
Для процессов, протекающих при постоянном объёме, соответственно, зависимость теплового эффекта от температуры описывается уравнением:
ΔUT = 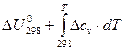 . (24)
. (24)
Пример 3. Определить теплоту, поглощённую при нагревании 100 г двуокиси углерода от 15 до 1000ºС при постоянном объёме, если
с 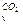 = 27,24 + 0,00809t Дж/моль·град.
= 27,24 + 0,00809t Дж/моль·град.
Решение. Объёмная теплоёмкость равна количеству теплоты, которое необходимо для нагревания на 1ºС 1м3 газа, приведённого к нормальным условиям. При повышении температуры от Т1 до Т2 количество поглощаемой теплоты можно рассчитать по формуле:
Q = 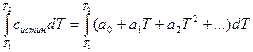 (для 1 моля вещества)
(для 1 моля вещества)
После интегрирования выражение примет вид:
Q=[a0 (T2 – T1) + a1 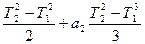 ]
]
При вычислении по данной формуле температуру можно брать в градусах Цельсия.
Число молей углекислого газа определяем по формуле
ν = 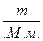
и тогда количество поглощённой теплоты в рассматриваемом процессе будет равно
Q = 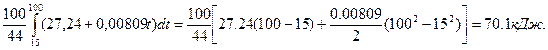
Дата добавления: 2014-12-07; просмотров: 1832;
