Процессы, протекающие при постоянном давлении и температуре.
Для выяснения возможности протекания изобарно-изотермических процессов используется функция состояния G, называемая изобарно-изотермическим потенциалом или свободной энергией Гиббса:
G = H – TS. (40)
Продифференцируем это уравнение с учётом выражения (6):
dG = dU + pdV + VdP – TdS – SdT. (41)
Величину dU находим из уравнения (37) и подставляем в (34):
dG ≤ Vdp – SdT. (42)
При постоянных величинах давления и температуры: dp = dT =0;
dG ≤0 (43)
При постоянных давлении и температуре самопроизвольно протекают только процессы, сопровождающиеся уменьшением изобарно-изотермического потенциала. Когда G достигает минимального в данных условиях значения, в системе устанавливается равновесие dG = 0 .
Следовательно, вычислив dG химической реакции, не проводя эксперимента, можно ответить о принципиальной возможности протекания данного химического процесса:
dG < 0 – в системе самопроизвольно протекает прямая реакция;
dG = 0 – в системе установилось химическое равновесие;
dG > 0 – в системе самопроизвольно протекает реакция в обратном направлении.
Изменение свободной энергии Гиббса можно вычислить по формуле:
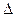 G
G 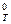 =
= 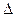 H
H 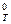 – T
– T 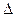 S
S 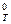 , (44)
, (44)
предварительно рассчитав тепловой эффект реакции 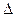 H
H 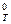 и изменение энтропии
и изменение энтропии 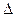 S
S 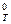 .
.
Изменение энергии Гиббса одновременно учитывает изменение энергетического запаса системы и степени её беспорядка.
Как и в случае изменения энтальпии и энтропии, к изобарно-изотермическому потенциалу применимо следствие из закона Гесса: изменение энергии Гиббса dG в результате химической реакции равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учётом их стехиометрических коэффициентов:
ΔG 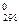 =
= 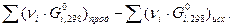 (45)
(45)
В реакциях, протекающих при постоянном давлении и температуре, связь между ΔG 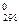 и константой равновесия Кр выражается с помощью уравнения изотермы химической реакции.
и константой равновесия Кр выражается с помощью уравнения изотермы химической реакции.
Предположим, что реакция протекает в смеси идеальных газов А, В, С и D, взятых в произвольных неравновесных количествах с соответствующими парциальными давлениями 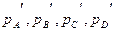 :
:
ν1А + ν2В ↔ ν3С + ν4D.
Уравнение изотермы для данного процесса имеет следующий вид:
ΔG 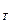 = ΔG
= ΔG 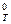 + RT ln
+ RT ln 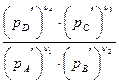 . (46)
. (46)
При протекании химической реакции спустя некоторое время наступает состояние химического равновесия. Это означает, что скорости прямой и обратной реакции становятся равными. В состоянии химического равновесия количество всех веществ А, В, С и D не будет меняться во времени.
Поскольку в момент равновесия ΔG 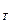 = 0, то уравнение изотермы для условий химического равновесия принимает вид:
= 0, то уравнение изотермы для условий химического равновесия принимает вид:
ΔG 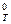 = - RT ln
= - RT ln 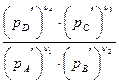 . (47)
. (47)
Обозначив
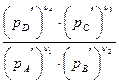 = Кр, (48)
= Кр, (48)
тогда получаем:
ΔG 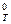 = - RT lnКр. (49)
= - RT lnКр. (49)
Для данной реакции при данной температуре Кр является постоянной величиной и называется константой равновесия химической реакции. Уравнение (48) связывает равновесные парциальные давления (рi, парц) веществ, участвующих в химическом процессе, и называется законом действия масс.
С помощью выражения (49) можно вычислить константу равновесия химической реакции, используя термодинамические таблицы:
Кр = exp 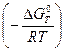 . (50)
. (50)
Большое значение Кр значит, что в равновесной смеси продуктов реакции значительно больше, чем исходных веществ. В подобном случае говорят о том, что равновесие реакции сдвинуто в сторону продуктов реакции, и процесс протекает преимущественно в прямом направлении. Соответственно, при малых значениях Кр прямая реакция протекает в незначительной степени, равновесие сдвинуто в сторону исходных веществ.
Пример 4. Не производя вычислений, установить знак ΔS 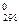 следующего процесса:
следующего процесса:
Н2О(г) = Н2(г) + ½ О2(г).
Решение. Для химических реакций, протекающих с изменением объёма, можно предсказать изменение энтропии без вычислений. В нашем случае для реакции разложения воды объём продуктов реакции больше объёма исходных веществ, следовательно, беспорядок и вероятность больше в правой части уравнения, т.е. сумма энтропий 1 моль Н2 и ½ моль О2 больше энтропии 1 моль Н2О. Таким образом, ΔSх.р.> 0.
Пример 5. Определить изменение энтропии ΔS 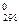 и изобарно-изотермического потенциала ΔG
и изобарно-изотермического потенциала ΔG 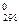 в стандартных условиях для реакции
в стандартных условиях для реакции
Fe3O4 + CO = 3 FeO + CO2
и решить вопрос о возможности самопроизвольного её протекания при указанных условиях.
Решение. Значения ΔS 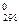 и ΔG
и ΔG 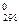 реакции вычисляем по следствию из закона Гесса:
реакции вычисляем по следствию из закона Гесса:
ΔS 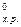 = 3 S
= 3 S 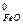 + S
+ S 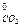 - S
- S 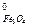 - S
- S 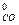
Находим значения ΔS 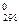 (Дж/моль·град) веществ по справочным данным таблицы 1 Приложения:
(Дж/моль·град) веществ по справочным данным таблицы 1 Приложения:
S 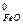 =58,79; S
=58,79; S 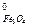 = 151,46; S
= 151,46; S 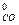 = 197,4; S
= 197,4; S 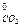 = 213,6;
= 213,6;
ΔS 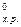 = 3 · 58,79 + 213,6 - 151,46 - 197,4 = 39,11 Дж/моль·град.
= 3 · 58,79 + 213,6 - 151,46 - 197,4 = 39,11 Дж/моль·град.
Значения стандартных величин ΔG 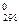 реагирующих веществ берём из таблицы 1 Приложения:
реагирующих веществ берём из таблицы 1 Приложения:
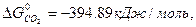
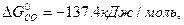
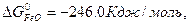
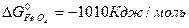
ΔG 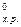 = 3
= 3 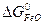 +
+ 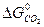 -
- 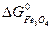 -
- 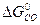
ΔG 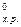 = 3 · (-246,0) – 394,89 + 1010 + 137,4 = = 14,51 кДж/моль.
= 3 · (-246,0) – 394,89 + 1010 + 137,4 = = 14,51 кДж/моль.
Таким образом, ΔG 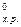 > 0. Следовательно, в стандартных условиях (Т=298К, Р=1атм.) самопроизвольный процесс восстановления Fe3O4 оксидом углерода невозможен.
> 0. Следовательно, в стандартных условиях (Т=298К, Р=1атм.) самопроизвольный процесс восстановления Fe3O4 оксидом углерода невозможен.
Пример 6. Вычислить стандартное изменение изобарного потенциала ΔG 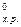 для процесса:
для процесса:
С2Н2 + 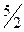 О2 = 2 СО2 + Н2Ож.
О2 = 2 СО2 + Н2Ож.
Воспользоваться табличными данными ΔН 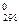 и ΔS
и ΔS 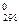
Решение. Используем формулу (44)
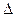 G
G 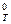 =
= 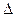 H
H 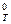 – T
– T 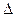 S
S 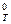
Находим по справочнику таблицы 1 Приложения стандартные значения энтальпии и энтропии веществ, участвующих в химической реакции:
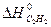 = 226,75 кДж/моль,
= 226,75 кДж/моль, 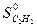 = 200,8 Дж/ моль ∙ град,
= 200,8 Дж/ моль ∙ град,
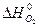 = 0,
= 0, 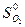 = 205,03 Дж/ моль ∙ град,
= 205,03 Дж/ моль ∙ град,
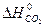 = -393,51 кДж/моль,
= -393,51 кДж/моль, 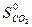 = 213,6 Дж/моль ∙ град,
= 213,6 Дж/моль ∙ град,
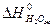 = -285,84 кДж/моль,
= -285,84 кДж/моль, 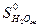 = 69,96 Дж/моль ∙ град.
= 69,96 Дж/моль ∙ град.
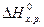 = 2
= 2 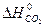 +
+ 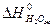 -
- 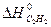 - 5/2
- 5/2 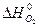 = 2·(-393,51) - 285,84 - 226,75 - 0 =
= 2·(-393,51) - 285,84 - 226,75 - 0 =
= - 1299,61 кДж/моль
ΔS 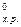 = 2
= 2 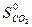 +
+ 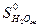 -
- 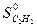 - 5/2
- 5/2 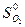 = 2·213,6 + 69,96 - 200,8 - 5/2 · 205,03 =
= 2·213,6 + 69,96 - 200,8 - 5/2 · 205,03 =
= - 216,21 Дж/моль ∙ град = -0,2162 кДж/моль ∙ град
ΔG 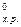 = - 1299,61 – (-0,2162)·298 = - 1235,19 кДж/моль.
= - 1299,61 – (-0,2162)·298 = - 1235,19 кДж/моль.
Вариант 1
1. Рассчитайте тепловой эффект реакции при 298 К и постоянном давлении:
2Н2 + СО = СН3ОН(ж)
Стандартные энтальпии образования веществ возьмите из справочника.
2. Укажите знак ΔS 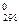 для реакции:
для реакции:
NH3(г) + HCl(г) = NH4Cl(к).
3. Каково изменение энтропии при охлаждении 5 молей воды от температуры кипения до температуры замерзания при 1 атм.; считая теплоёмкость воды постоянной и равной 17,96 Дж/моль·К.
4. Определите возможность самопроизвольного протекания химической реакции при стандартных условиях, для которой ΔН0 = -50 кДж/моль, ΔS0 = 18 Дж/моль∙К.
Вариант 2
1. Рассчитайте тепловой эффект реакции при 298 К и постоянном давлении:
4НСl + O2 = 2H2O(ж) + 2Cl2
Стандартные энтальпии образования веществ возьмите из справочника.
2. Укажите знак ΔS 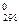 для реакции:
для реакции:
COCl2(г) = CO(г) + Cl2(г).
3. Каково изменение энтропии при конденсации 1 моля паров ртути при температуре кипения (630 К), если её теплота испарения 59,36 кДж/моль.
4. Для некоторой реакции ΔН0 = 100 кДж/моль, а ΔS0 = 40 Дж/моль∙К. При какой температуре установится равновесие, если ΔН0 и ΔS0 от температуры не зависят?
Вариант 3
1. Рассчитайте тепловой эффект реакции при 298 К и постоянном давлении:
4NH4Cl(тв) = NH3 + HCl
Стандартные энтальпии образования веществ возьмите из справочника.
2. Укажите знак ΔS 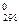 для реакции:
для реакции:
PCl3(г) + Cl2(г) = PCl5(г).
3. Каково изменение энтропии при охлаждении4,4 г газообразного диоксида углерода от 600 К до 300 К (средняя молярная теплоёмкость в этом интервале температур равна 37,07 Дж/моль·К).
4. Тепловой эффект некоторой реакции ΔН0 = +50 кДж/моль и не зависит от температуры; при температуре 1250 К в системе установилось равновесие. Чему равно изменение энтропии в ходе этой реакции?
Вариант 4
1. Рассчитайте тепловой эффект реакции при 298 К и постоянном давлении:
2N2 + 6H2О(ж) = 4NH3 + 3O2
Стандартные энтальпии образования веществ возьмите из справочника.
2. Укажите знак ΔS 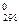 для реакции:
для реакции:
2NO2(г) + O2(г) = 2NO(г).
3. Каково изменение энтропии при превращении 1 моля льда в воду при 0º С?
4. Изменение стандартной свободной энергии Гиббса для одной реакции ΔG 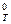 = -25 кДж/моль, а для другой - ΔG
= -25 кДж/моль, а для другой - ΔG 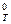 = 35 кДж/моль. Какая из двух реакций характеризуется большей величиной константы равновесия? Какая реакция протекает полнее?
= 35 кДж/моль. Какая из двух реакций характеризуется большей величиной константы равновесия? Какая реакция протекает полнее?
Вариант 5
1. Рассчитайте тепловой эффект реакции при 298 К и постоянном давлении:
2NO + 6H2О(ж) = 4NH3 + 5O2
Стандартные энтальпии образования веществ возьмите из справочника.
2. Укажите знак ΔS 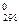 для реакции:
для реакции:
I2(к) = I2(г).
3. Определите разность энтропий 1 г воды при 0 и 100º С (давление нормальное), считая теплоёмкость воды постоянной и равной 4,19 Дж/г·град.
4. Определите изменение изобарно-изотермического потенциала ΔG 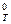 при стандартных условиях для реакции:
при стандартных условиях для реакции:
Fe3O4 + CO = 3 FeO + CO2
и решите вопрос о возможности самопроизвольного протекания её при указанных условиях.
Вариант 6
1. Рассчитайте тепловой эффект реакции при 298 К и постоянном давлении:
2NO2 = 2NO + O2
Стандартные энтальпии образования веществ возьмите из справочника.
2. Укажите знак ΔS 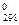 для реакции:
для реакции:
H2O(ж) = H2O(к)..
3. Средняя удельная теплоёмкость железа в пределах температур 0 - 200º С равна 0,486 Дж/г·град. Определите изменение энтропии при нагревании 1 кг железа от 100 до 150º С.
4. Используя табличные значения ΔН 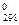 и ΔS
и ΔS 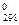 , вычислите стандартное изменение изобарного потенциала ΔG
, вычислите стандартное изменение изобарного потенциала ΔG 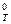 для реакции
для реакции
С2Н2 + 5/2 О2 = 2 СО2 + Н2О(ж).
Вариант 7
1. Рассчитайте тепловой эффект реакции при 298 К и постоянном давлении:
N2O4 = 2NO2
Стандартные энтальпии образования веществ возьмите из справочника.
2. Укажите знак ΔS 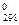 для реакции:
для реакции:
2NO2(г) = N2O4(г)..
3. Определите изменение энтропии при охлаждении 5 г-атом алюминия от 0 до -100º С. Средняя удельная теплоёмкость алюминия в указанном интервале температур 0,8129 Дж/г∙град.
4. Изменение стандартной свободной энергии Гиббса для реакции:
2 Н2(г) + СО(г) = СН3ОН(г)
равно -25,21 кДж/моль. Рассчитайте величину константы равновесия.
Вариант 8
1. Рассчитайте тепловой эффект реакции при 298 К и постоянном давлении:
Mg(OH)2 = MgO + H2O(г)
Стандартные энтальпии образования веществ возьмите из справочника.
2. Укажите знак ΔS 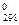 для реакции:
для реакции:
СаСО3(к) = СаО(к) + СO2(г)
3. Чему равно изменение энтропии 1 моля нафталина при нагревании от 0 до 80,4ºС (температура плавления), если теплота плавления 149,6 Дж/г, а средняя удельная теплоёмкость твёрдого нафталина 1,315 Дж/г∙град?
4. Константа равновесия реакции
4 HCl(г) + O2(г) = 2 H2O(г) + 2 Cl2(г)
при 100 К равна 6,02 ∙ 10-7. Чему равно изменение свободной энергии Гиббса при этой температуре?
Вариант 9
1. Рассчитайте тепловой эффект реакции при 298 К и постоянном давлении:
СаСО3= СаО + СO2
Стандартные энтальпии образования веществ возьмите из справочника.
2. Укажите знак ΔS 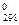 для реакции:
для реакции:
2NH3(г) = N2(г) + 3H2(г).
3. Вычислите изменение энтропии ΔS0 при стандартных условиях для реакций:
2H2S + SO2 = 2 H2O(ж) + 3S(к)
Zn + H2SO4(ж) = ZnSO4 + H2
CH4 + 2O2 = CO2 + 2H2O(г)
Стандартные значения S0 реагирующих веществ возьмите из справочника.
4. Для реакции: N2O4(г) = 2 NO(г) изменение свободной энергии Гиббса при температуре 1000 К равно ΔG 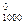 = 6,28 кДж/моль. парциальные давления газов в смеси: р
= 6,28 кДж/моль. парциальные давления газов в смеси: р 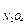 =3,7 атм, р
=3,7 атм, р 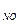 = 1,5 атм. В каком направлении будет самопроизвольно протекать эта реакция?
= 1,5 атм. В каком направлении будет самопроизвольно протекать эта реакция?
Вариант 10
1. Рассчитайте тепловой эффект реакции при 298 К и постоянном давлении:
Са(ОН)2 = СаО + Н2О(г)
Стандартные энтальпии образования веществ возьмите из справочника.
2. Укажите знак ΔS 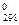 для реакции:
для реакции:
2H2S(г) + O2(г) = 2S(к) + 2H2O(ж)..
3. Вычислите изменение энтропии ΔS0 при стандартных условиях для реакций:
2С2H5Cl + 2Na = C4H10 + 2NaCl
2СН3ОН = СН3 – О – СН3 + Н2О(ж)
С2Н5ОН + СН3СООН = СН3СООС2Н5 + Н2О(ж)
Стандартные значения S0 реагирующих веществ возьмите из справочника.
4. Определите возможность самопроизвольного протекания химической реакции при стандартных условиях, для которой ΔН0 = +40 кДж/моль, ΔS0 = -30 Дж/моль∙К.
Дата добавления: 2014-12-07; просмотров: 6172;
