Идеальный газ
Характерными свойствами любого газа являются стремление занять как можно больший объём и сильная зависимость объёма от давления и температуры. Исходя из внешних признаков, газ – это такое состояние вещества, в котором вещество не имеет ни собственного определённого объёма, ни определённой формы.
Экспериментальным путём установлено, что объём любого газа зависит от трёх параметров: температуры – Т, давления – Р, числа молекул – N. Существуют законы, описывающие зависимость объёма от каждого из трёх параметров при постоянстве двух других:
1. Закон Бойля-Мариотта:при постоянной температуре объём данной массы газа обратно пропорционален давлению:
РV = const (T,N – const) (51)
При постоянной температуре объёмы данной массы газа обратно пропорциональны давлениям, под которыми находится газ:
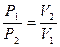 (52)
(52)
Плотности газа ρ и его концентрация С при постоянной температуре прямо пропорциональны давлениям:
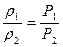 , (53)
, (53)
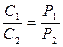 . (54)
. (54)
2. Законы Гей-Люссака – Шарля:при постоянном давлении объём данной массы газа прямо пропорционален абсолютной температуре:
V/T = const (P,N – const). (55)
При постоянном объёме давления данной массы газа прямо пропорциональны абсолютным температурам:
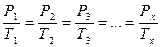 . (56)
. (56)
Плотности и концентрации газа, находящегося под постоянным давлением, изменяются обратно пропорционально абсолютным температурам:
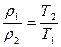 , (57)
, (57)
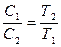 . (58)
. (58)
Зависимость между объёмами, давлениями и температурами для одной и той же массы газа выражается уравнением, объединяющим законы Бойля – Мариотта, Шарля и Гей – Люссака:
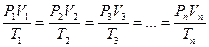 , (59)
, (59)
где V1 – объём газа при температуре Т1 и давлении Р1; V2 – объём газа при температуре Т2 и давлении Р2 и т.д.
3. Закон Авогадро:при постоянных температуре и давлении в равных объёмах газов содержится одинаковое число молекул
V/N = const (P,T – const)
Из закона Авогадро вытекает важное следствие: при одинаковых условиях молярные объёмы всех газов одинаковы. При нормальных условиях (Р=1атм) молярный объём газа V0=22,4 л.
Дата добавления: 2014-12-07; просмотров: 1564;
