ИДЕАЛЬНЫЙ ГАЗ
Идеальным называется газ, удовлетворяющий трем условиям:
1. можно пренебречь взаимодействием молекул;
2. можно пренебречь собственным объемом молекул;
3. соударения молекул можно рассматривать как абсолютно упругие.
Азот N2, кислород O2 , водород H2, пары воды H2O и другие газы при условиях, близких к нормальным, удовлетворяют условиям идеальности.
Нормальные условия (н.у.):
температура t=0°С и давление p=760 мм.рт.ст.=101,3 кПа.
Характеристиками молекул газа при их хаотичном тепловом движении являются:
1. Эффективный диаметр d молекулы – минимальное расстояние, на которое сближаются молекулы при соударениях.
2. Средняя арифметическая скорость молекул

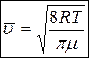 . (5)
. (5)
3. Средняя длина свободного пробега 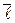 молекулы - среднее расстояние, которое пролетает молекула между двумя последовательными соударениями,
молекулы - среднее расстояние, которое пролетает молекула между двумя последовательными соударениями,
 . (6)
. (6)
4. Среднее число 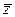 столкновениймолекул в единицу времени,
столкновениймолекул в единицу времени,
 . (7)
. (7)
Законы идеального газа:
1. Закон Дальтона: давление 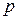 смеси газов равно сумме парциальных давлений
смеси газов равно сумме парциальных давлений
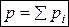 . (8)
. (8)
Парциальное давление – это давление, которое оказывал бы один газ из смеси, если бы занимал весь объем сосуда. Из закона Дальтона следует, что количество молей ν смеси равно сумме молей отдельных газов
ν=ν1+ν2+ν3+… (9)
2. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
 , (10)
, (10)
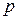 -давление газа,
-давление газа, 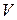 - его объем,
- его объем, 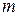 – масса газа,
– масса газа, 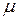 - молярная масса,
- молярная масса, 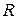 =8,31 Дж/(моль·К) – газовая постоянная,
=8,31 Дж/(моль·К) – газовая постоянная,  – температура в Кельвинах.
– температура в Кельвинах.
Также уравнение состояния записывают в форме
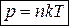 , (11)
, (11)
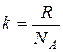 =1,38·10-23 Дж/K – постоянная Больцмана,
=1,38·10-23 Дж/K – постоянная Больцмана,  - концентрация молекул.
- концентрация молекул.
Дата добавления: 2014-12-13; просмотров: 1547;
